
分析 (1)根据题意提供信息,仿照Fe3O4的氧化物形式书写Pb3O4氧化物,把氧化物改写成盐的形式时,要把化合价较低的元素作为阳离子,把化合价较高的元素和氧元素组成酸根;
(2)根据氧化还原反应正确书写三氧化二铅与浓盐酸反应的化学方程式;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系.
解答 解:(1)Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式为:PbO和PbO2,那么Pb2O3的氧化物的表示形式可以写成 PbO•PbO2;
故答案为:PbO•PbO2;
(2)Pb2O3中Pb的化合价只有+2、+4,再根据化合价代数和等于零,求得Pb的总化合价为+3价,即可确定Pb2O3中有一个+4价、有一个+2价,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,根据元素守恒得反应物与生成物:Pb2O3+HCl(浓)→PbCl2+Cl2↑+H2O,根据化合价升降法配平该氧化还原反应,Pb2O3中一个+4价的Pb降低到+2价,降低2价;HCl(浓)中-1价的Cl上升到0价生成Cl2,上升1价×2,所以Pb2O3和Cl2前面的计量数都为1,根据原子守恒配平其它物质前计量数,得各物质前计量数为1、6、2、1、3,故方程式为Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O;
故答案为:Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O;
(3)根据题意:amol PbO2分解所得混合物中n(Pb2+)=ax mol、n(Pb4+)=(a-ax) mol.在反应过程中amol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,
根据得失电子守恒:先加热分解生成O2,得n(O2)═$\frac{2ax}{4}$=$\frac{ax}{2}$mol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)═$\frac{(a-ax)mol×2}{2}$═(a-ax) mol,
则 y═n(O2)+n(Cl2)═$\frac{ax}{2}$mol+(a-ax) mol═(a-$\frac{ax}{2}$)mol,
故答案为:y═a(1-0.5x)mol.
点评 本题是信息给予题,该题型是中考中亮点,主要考查学生分析信息、提取信息并结合已有知识正确书写化学方程式的能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
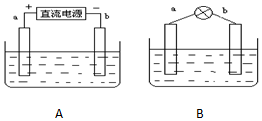 采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:
采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 等物质的量的甲烷和一氧化碳所含的分子数前者大于后者 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 向饱和氯化钠溶液中加入一小块钠,恢复原温度后溶液中有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯酚能与NaOH溶液反应而苯甲醇不能 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 | |
| C. | 苯与液溴在催化剂存在下发生反应,而苯酚与浓溴水混合就能发生反应 | |
| D. | 等物质的量的乙醇和乙二醇与足量的金属钠反应,后者产生的氢气比前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
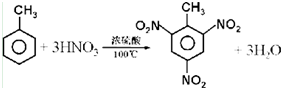
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
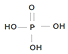 (为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为
(为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为 ;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.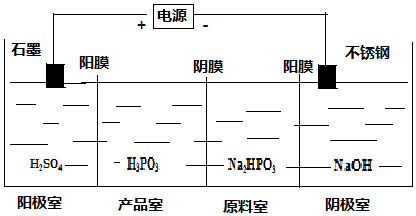
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com