
分析 (1)由于实验室无450mL容量瓶,故应选择500mL的容量瓶.根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,故配制出500mL溶液.根据所需的质量m=CVM来计算;
(3)溶液为均一稳定的混合物,所以溶液的物质的量浓度、密度不受体积影响,而氢氧化钠的物质的量、溶液中氢氧根离子数目与溶液体积有关;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)由于实验室无450mL容量瓶,故应选择500mL的容量瓶.根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故不需要使用的是D,故答案为:D;
(2)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,故配制出500mL溶液.故所需的质量m=CVM=0.2mol/L×0.5L×40g/mol=4.0g,故答案为:4.0;
(3)A.溶液具有均一性,所以氢氧化钠溶液的浓度与溶液的体积大小没有关系,故A正确;
B.根据n=cV可知,溶液中NaOH的物质的量与溶液体积大小有关,故B错误;
C.溶液为均一、稳定的混合物,所以溶液的密度与溶液体积大小无关,故C正确;
D.溶液中OH-的数目与氢氧化钠的物质的量有关,根据n=cV可知,氢氧根离子的数目与溶液的体积大小有关,故D错误;
故选AC;
(4)①转移溶液后烧杯玻璃棒未进行洗涤就进行定容,会导致溶质的损失,则溶液浓度偏低,故答案为:偏低;
②氢氧化钠在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,则冷却后溶液体积偏小,浓度偏高,故答案为:偏高;
③在容量瓶中定容时仰视容量瓶刻度线,则溶液体积偏大,浓度偏低,故答案为:偏低;
④容量瓶洗涤后未干燥即用来配制溶液,对溶液浓度无影响,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属铝加到硝酸汞溶液中:2Al+3Hg2+═2Al3++3Hg | |
| B. | 硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| C. | 饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
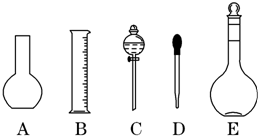 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g 18O2中含有NA个氧原子 | |
| B. | 1 mol FeI2与足量氯气反应对转移的电子数为2NA | |
| C. | 1 mol Cl2参加反应转移电子数一定为2 NA | |
| D. | 标准状况下,2.24L四氯化碳含有分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-在水溶液中的水解方程式:HCO3-+H2O?H3O++CO32- | |
| B. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| C. | AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH)3 | |
| D. | NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr是双原子分子 | |
| B. | 在很多反应中IBr是氧化剂 | |
| C. | 和水反应时IBr既是氧化剂又是还原剂 | |
| D. | 和NaOH溶液反应生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有10NA个电子 | |
| B. | 46g的NO2气体中含有NA个NO2分子 | |
| C. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com