
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3﹣的反应原理如图1所示. 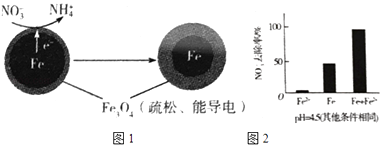
②作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: . pH=4.5(其他条件相同)
【答案】
(1)铁;NO3﹣+8e﹣+10H+=NH4++3H2O
(2)FeO(OH)不导电,阻碍电子转移
(3)本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率;Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移
【解析】解:(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极,故答案为:铁;②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据图2信息可知为酸性环境,则正极的电极反应式为:NO3﹣+8e﹣+10H+=NH4++3H2O,
故答案为:NO3﹣+8e﹣+10H+=NH4++3H2O;(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3﹣的去除率低.
故答案为:FeO(OH)不导电,阻碍电子转移;(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3﹣的去除率为0,因此得出Fe2+不能直接还原NO3﹣;而Fe和Fe2+共同加入时NO3﹣的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率;②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移.
(1)①Fe还原水体中NO3﹣ , 根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据图2信息可知为酸性环境;(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;(3)①根据图2中的三个实验结果进行分析;②结合(2)题中的铁的最终物质形态结果差异进行分析.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1: 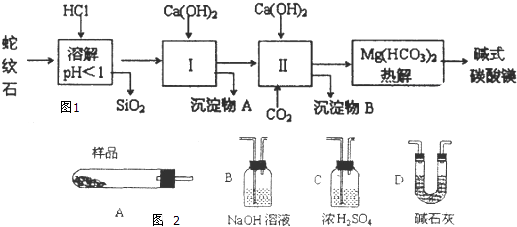
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后、、灼烧(填实验操作名称).灼烧操作需在中进行(填写仪器名称),上述实验中,可以循环利用的物质是(填化学式).
(4)现设计实验,确定产品aMgCO3bMg(OH)2cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ , ⑤称量MgO的质量.
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→…→”表示)
(6)18.2g产品完全分解后.产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中 a= , b= , c= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
A. A>B>C>DB. D>A>B>C
C. D>B>A>CD. D> C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成: 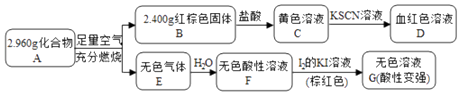
请回答:
(1)A的化学式为 . A煅烧生成B和E的化学方程式为 .
(2)溶液C可溶解铜片,反应的离子方程式为 , 例举该反应的一个实际应用是
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g/L),该气体分子的电子式为 . 该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO33H2O.实验过程如图1: 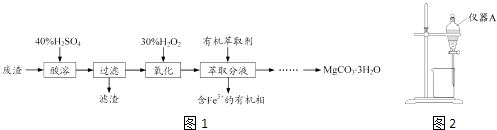
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)═Mg2+(aq)+CO2(g)+H2O(l)△H=﹣50.4kJmol﹣1
Mg2SiO4(s)+4H+(aq)═2Mg2+(aq)+H2SiO3(s)+H2O(l)△H=﹣225.4kJmol﹣1
酸溶需加热的目的是_;所加H2SO4不宜过量太多的原因是 .
(2)加入H2O2氧化时发生发应的离子方程式为
(3)用图2所示的实验装置进行萃取分液,以除去溶液中的Fe3+ .
①实验装置图中仪器A的名称为 .
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,、静置、分液,并重复多次.
(4)请补充完整由萃取后得到的水溶液制备MgCO33H2O的实验方案:边搅拌边向溶液中滴加氨水, , 过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO33H2O.
已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
A. 2NaOH + H2SO4 = Na2SO4+2H2O
B. Ba(OH)2+2HCl = BaCl2+2H2O
C. Cu(OH)2+ 2HNO3=Cu(NO3)2+2H2O
D. KOH+ HCl = KCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,发生“先产生沉淀,然后沉淀又完全溶解”现象的是( )
A.向硫酸铝溶液中逐滴加入过量氨水
B.向硫酸铝溶液中逐滴加入过量氢氧化钡溶液
C.向硅酸钠溶液中逐滴加入过量稀盐酸
D.向氢氧化钡溶液中缓缓通入过量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3 , Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 , 该元素的符号是 .
(2)Y元素原子的价层电子的轨道表示式为 .
(3)X与Z可形成化合物XZ3 , 该化合物的空间构型为 .
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低 , 理由是 .
(5)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3 , 产物还有ZnSO4和H2O,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于淀粉的认识中,不正确的是 ( )
A.淀粉属于糖类,有甜味
B.淀粉属于高分子化合物
C.淀粉与碘水作用呈现蓝色
D.淀粉在人体内能够水解,生成葡萄糖,经肠壁吸收进入血液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com