
【题目】下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置。(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)
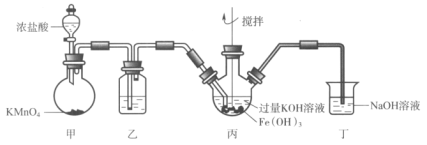
下列说法不正确的是( )
A.乙中所用试剂为饱和食盐水
B.丙和丁中均会发生反应:Cl2+2OH-=Cl-+ClO-+H2O
C.丙中产生紫色固体,说明碱性条件下,Cl2氧化性强于K2FeO4
D.若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,则证明了K2FeO4具有氧化性
【答案】D
【解析】
甲中发生反应为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,乙中装饱和食盐水除去氯气中的HCl气体,丙中制备K2FeO4,丁为尾气处理。
A.甲中生成的氯气中含有少量的氯化氢气体,乙中装饱和食盐水除去氯气中的HCl气体,正确,A不符合题意;
B.丙中有KOH,丁中有NaOH,均与氯气发生反应,其离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,正确,B不符合题意;
C.丙中发生反应为:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+6KCl+8H2O,Cl元素化合价降低,发生还原反应,氯气作氧化剂,氧化剂的氧化性强于氧化产物,所以氧化性:Cl2>K2FeO4,正确,C不符合题意;
D.反应后丙中紫色溶液中含有:K2FeO4、KCl、KClO,加入稀硫酸产生Cl2,有可能发生反应为:ClO-+Cl-+2H+=Cl2↑+H2O,不能证明K2FeO4具有氧化性,错误,D符合题意。
答案为:D。


科目:高中化学 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置为________________。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________;所含化学键类型_________。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________。
Ⅱ.如下图转化关系:![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了近代化学发展的几个重要里程碑。下列说法正确的是( )

A.1661年波义耳提出了元素的概念并发现了同位素
B.1774年拉瓦锡提出燃烧的氧化学说并揭示了氧化还原反应的本质
C.1803年道尔顿提出原子学说并揭示了原子构成的奥秘
D.1869年门捷列夫发现了元素周期律并制成了第一张元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
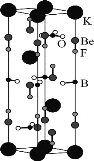
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问:
(1)若a+b=14,则Va∶Vb=___。
(2)若a+b=13,则Va∶Vb=___。
(3)若a+b>14,则Va∶Vb=___,且Va___Vb(填“>”“<”或“=”)。
(4).25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。(书写步骤)
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=________。
②若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b的值可否等于4________(填“可以”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
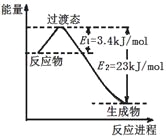
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:

①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
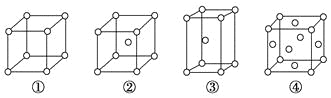
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的镁铝合金与![]() 稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。下列说法 不正确的是
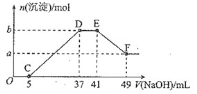
A.![]()
B.OC段反应的离子方程式为![]()
C.D点对应溶液中的溶质为![]() 和
和![]()
D.原![]() 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com