
����Ŀ�������£���0.1L0.2mol/LKMnO4������Һ��һ����pH=3�IJ��ᣨHOOC-COOH����Һ��ϣ��ų�VL���塣NA���������ӵ�������ֵ������˵����ȷ����
A. pH=3�IJ�����Һ����H+��ĿΪ0.001NA
B. ��1molKMnO4����ԭʱǿ���ṩH+��ĿΪNA
C. 1molHOOC-COOH�����õ��Ӷ���ĿΪ9NA
D. �÷�Ӧ�ͷ�CO2������ĿΪ![]()
���𰸡�C
��������A��û�и�����Һ����������㣬ѡ��A����B�����ݷ�Ӧ2MnO4-+ 5HOOC-COOH +6H+=2Mn2++10CO2��+8H2O��֪����1molKMnO4����ԭʱǿ���ṩH+��ĿΪ3NA��ѡ��B����C��C. HOOC-COOH�����к��ж���̼��˫����һ��̼̼����������̼��������������������ÿ�����ӹ��й�9�Թ��õ��Ӷԣ���1molHOOC-COOH�����õ��Ӷ���ĿΪ9NA��ѡ��C��ȷ��D�����DZ�״���£�������22.4L/mol���㣬��ȷ����ѡ��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ���¡����ݵ��ܱ������з�����Ӧ��3H2(g)+N2(g)![]() 2NH3(g)����H<0��t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ��ʾ������˵����ȷ����
2NH3(g)����H<0��t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ��ʾ������˵����ȷ����

A. �������̴ﵽƽ��ʱ��ƽ�ⳣ����K��<K��
B. �������̴ﵽƽ��ʱ��NH3�������������<��
C. �������̴ﵽƽ��ı�־�������ƽ���ܶȲ��ٷ����仯
D. t2ʱ�̸ı���������������ܱ������м�H2��N2�Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ�ʯ(��Ҫ�ɷ�SiO2)Ϊ��ʼԭ�������ߴ��ྦྷ��ļ�����������ͼ��ʾ��
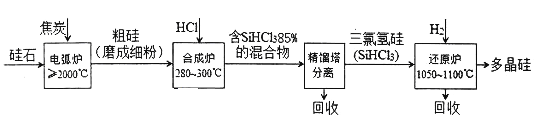
(1)�ڵ绡¯�У����ɴֹ�Ļ�ѧ����ʽΪ____________���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ_____________��
(2)�ϳ�¯���йط�Ӧ���������±���ʾ��
�Ȼ�ѧ����ʽ | ƽ�ⳣ�� | |
����Ӧ | Si(s)+3HCl(g) | K1 |
����Ӧ | Si(s)+4HCl(g) | K2 |
������Ӧ���¶����ϸ������280��300��֮�䣬���¶ȹ��ͣ���__________________�����¶�̫�ߣ�SiHCl3���ת������SiCl4����ת�����Ȼ�ѧ����ʽΪ_____________________��
��ƽ��ʱ��![]() ��ֵa����
��ֵa����![]() ��ֵb�ı仯���仯����
��ֵb�ı仯���仯����![]() =______(�ú�K1��K2�Ĵ���ʽ��ʾ)����ҵ����H2�ʵ�ϡ��HCl�����
=______(�ú�K1��K2�Ĵ���ʽ��ʾ)����ҵ����H2�ʵ�ϡ��HCl�����![]() ��ֵ������ƽ���ƶ�ԭ�����Խ���________________________��
��ֵ������ƽ���ƶ�ԭ�����Խ���________________________��
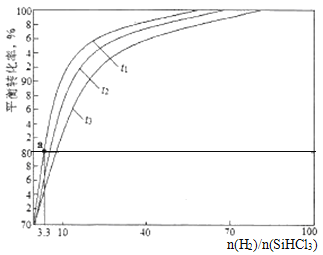
(3)��ԭ¯�е���Ҫ��ӦΪSiHCl3(g)+H2(g)=Si(s)+3HCl(g) ��H>0��ʵ��������1.0L�ܱ��������о��õ�SiHCl3��ת�����ڲ�ͬ�¶���������n(H2)/(SiHCl3)�仯��������ͼ��ʾ��t1��t2��t3��ʾ���¶ȸߵ�˳��Ϊ_______��t1�¶�ʱƽ�ⳣ��Ka=______(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ƽ��״̬�ķ�ӦX(g) ��3Y(g)![]() 2Z(g) (����Ӧ�Ƿ��ȷ�Ӧ) ��Ϊ��ʹƽ��������Z�ķ����ƶ��� Ӧѡ���������
2Z(g) (����Ӧ�Ƿ��ȷ�Ӧ) ��Ϊ��ʹƽ��������Z�ķ����ƶ��� Ӧѡ���������
�������¶ȡ��ڽ����¶ȡ�������ѹǿ���ܽ���ѹǿ���ݼ����������������Z
A. �٢ۢ� B. �ڢۢ� C. �ڢۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����Ԫ���ǹ������������ҪԪ�أ��ڶ�ֲ���������������Ҫ���á�����Ҫ��ش��������⣺
��1����ԭ�Ӻ�����___________�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬��ԭ�Ӻ�������Ų�ͼΪ___________��
��2����֪��(NH4)2CO3![]() 2NH3��+H2O��+CO2��
2NH3��+H2O��+CO2��
������ͬ���ڣ��ҵ�һ�����ܱ������Ԫ����___________�֡�
�ڷֽ����õ���̬��������ӵļ�����С�����˳��Ϊ___________(�ѧʽ)��
��3������ ����CO32���е�̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ___________��
����CO32���е�̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ___________��
��4�������[Cu(CH3C��N)4]BF4��ͭԭ�ӵļ۵����Ų�ʽ��___________��BF4���Ŀռ乹��Ϊ___________��д����BF4����Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ��___________��___________��
��5��̼Ԫ���뵪Ԫ���γɵ�ij�־���ľ�����ͼ��ʾ(8��̼ԭ��λ��������Ķ��㣬4��̼ԭ��λ������������ģ�4����ԭ������������)���þ���Ӳ�ȳ������ʯ����Ϊ����һָ�ij�Ӳ�²��ϡ�
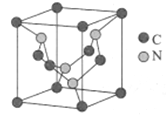
�پ�����Cԭ�ӵ���λ��Ϊ___________���þ���Ӳ�ȳ������ʯ��ԭ����___________��
����֪�þ����ı߳�apm�������ӵ�������NA��ʾ����þ�����ܶ�Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����嫵ĺ�����һ��������ʱ��⣬��ҵ�ϳ���Ũ����ˮ��ȡ�壮

����˵������ȷ���ǣ�������
A.��ˮ�ĵ���������Ҫ�������������������ӽ�������
B.����������������ӷ�������
C.����۷�Ӧ�����ӷ���ʽΪBr2+SO2+2H2O�T2HBr+2H++SO42��
D.�٩���Ŀ����Ϊ�˸�����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.05mol/LNaOH��Һ�ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.10 mol/LCH3COOH( Ka=l��10-5����ҺHCN��Ka=5��10-10����Һ�����õζ�������ͼ������˵����ȷ����

A. ����������ζ�����ѡ�ü�����ָʾ��
B. �۴���Һ�У�c(Na+)��c(CH3COO-)��c(CH3COOH)
C. ��Һ��ˮ�ĵ���̶ȣ���>��>��
D. ��ٺ͵����Һ��Ϻ�c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������˵��������ǣ� ��
A.�����ǻ���ɫ����
B.������ǿ�Ҵ̼�����ζ���ж�
C.������ʹ�������ɫ������ɫ
D.�����ǻ��õķǽ������ʣ����к�ǿ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ�˷���ͬ��������������
A. ���������
B. �Ȼ�����Ȼ��Ƶ��ܽ�
C. ������C60���ۻ�
D. ��ɱ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com