
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上.
实验所用仪器:a蒸发皿 b石棉网 c泥三角 d表面皿 e坩埚钳 f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是________
a灼烧过程中部分氧化铜被还原 b灼烧不充分铜未被完全氧化
c氧化铜在加热过程中分解生成铜 d该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________、________
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行________次
(6)若测定结果x值偏高,可能的原因是________
a加热温度过高 b胆矾晶体的颗粒较大
c加热后放在空气中冷却 d胆矾晶体部分风化
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省安师大附中高三上学期第四次模拟考试化学试卷 题型:实验题
(16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行 铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三上学期第四次模拟考试化学试卷 题型:实验题
(16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
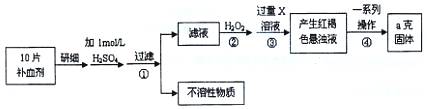
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市高三第一次考试化学试卷 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO—4+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是____。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com