
【题目】某研究小组利用麦芽酚 A 制备某药物中间体 X, 其合成路线如下
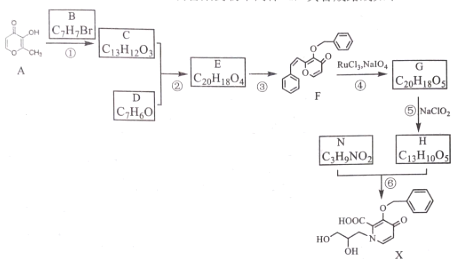
已知:

请回答 :
(l)化合物F的含氧官能团名称为__________,化合物E 的结构简式为____________。
(2)写出反应① 的化学方程式:_________________ 。
(3)下列说法不正确的是__________ ( 填字母序号)。
A.化合物 E 可发生取代、加成、消去、氧化、还原等反应
B.化合物 N 的同分异构体可能是某氨基酸
C.反应③属于消去反应
D.化合物X在一定条件下反应生成的物质中可能含有3个六元环
(4) 写出化合物H同时符合下列条件的同分异构体的结构简式______________。
a.IR 谱检测表明:分子中含有2个独立的苯 环,不含其他的环 ;
b.1H - NMR 谱表明:分子中共有3种化学环境不同的氢原子;
(5)由乙烯和苯为原料合成 D, 利用已知信息,设计合成路线(用流程图表示,无机试剂任选)__________________。
【答案】羰基、醚键 
![]() B
B 

【解析】
A与B反应生成C,C与D反应生成E,E在一定条件下生成F,根据F的结构式,F的分子式为C20H16O3,与E相比少2个H和一个O,结合B、C、D、E的分子式,可得B的结构式为![]() ,C的结构简式为
,C的结构简式为 ,D的结构简式为
,D的结构简式为![]() ,E的结构简式为
,E的结构简式为 ,结合已知信息,F在RuCl3和NaIO4作用下生成G,G的结构简式为
,结合已知信息,F在RuCl3和NaIO4作用下生成G,G的结构简式为 ,G在NaClO2作用下生成H,H的结构式
,G在NaClO2作用下生成H,H的结构式 ,H和N反应生成X,N的结构简式为
,H和N反应生成X,N的结构简式为![]() ,据此分析解答。
,据此分析解答。
(l)化合物F的结构简式为 ,则含氧官能团名称为羰基、醚键;结合分析,化合物E 的结构简式为
,则含氧官能团名称为羰基、醚键;结合分析,化合物E 的结构简式为 ;
;
(2)根据分析,反应①为A与B发生取代反应生成C,B的结构式为![]() ,C的结构简式为
,C的结构简式为 ,化学方程式:
,化学方程式:![]() ;
;
(3)A.E的结构简式为 ,含有苯环、醚键、羟基和羰基,结合官能团的性质,苯环可发生取代和加成,羟基可发生消去和氧化,羰基可发生还原,故A正确;
,含有苯环、醚键、羟基和羰基,结合官能团的性质,苯环可发生取代和加成,羟基可发生消去和氧化,羰基可发生还原,故A正确;
B.N的结构简式为![]() ,分子式为C3H9NO2,不饱和度为零,若化合物 N 的同分异构体可能是某氨基酸,含有羧基,一个碳氧双键的不饱和度为1,同分异构体的不饱和度是不变的,故B错误;
,分子式为C3H9NO2,不饱和度为零,若化合物 N 的同分异构体可能是某氨基酸,含有羧基,一个碳氧双键的不饱和度为1,同分异构体的不饱和度是不变的,故B错误;
C.E的结构简式为 ,F的结构简式为
,F的结构简式为 ,F与E相比少2个H和一个O,形成一个双键,反应③属于消去反应,故C正确;
,F与E相比少2个H和一个O,形成一个双键,反应③属于消去反应,故C正确;
D.化合物X的结构简式为 ,含有羟基和羧基,在一定条件下可发生分子内酯化反应,生成的物质中可能含有3个六元环,故D正确;
,含有羟基和羧基,在一定条件下可发生分子内酯化反应,生成的物质中可能含有3个六元环,故D正确;
(4)化合物H的结构简式为 ,a.IR 谱检测表明:分子中含有2个独立的苯 环,不含其他的环;b.1H - NMR 谱表明:分子中共有3种化学环境不同的氢原子;同时符合下列条件的同分异构体的结构简式有
,a.IR 谱检测表明:分子中含有2个独立的苯 环,不含其他的环;b.1H - NMR 谱表明:分子中共有3种化学环境不同的氢原子;同时符合下列条件的同分异构体的结构简式有 ;
;
(5)由乙烯和苯为原料合成 D,利用已知信息,合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】α-Fe(Ⅲ)铁原子簇是合成氨工业的新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①H2(g)═2H(g) △H1,②N2(g)+2H(g)![]() 2(NH)(g) △H2,③NH(g)+H(g)
2(NH)(g) △H2,③NH(g)+H(g)![]() (NH2) △H3,④(NH2)(g)+H(g)
(NH2) △H3,④(NH2)(g)+H(g)![]() NH3(g) △H4,总反应为N2(g)+3H2(g)
NH3(g) △H4,总反应为N2(g)+3H2(g)![]() 2NH3(g) △H。下列说法正确的是( )
2NH3(g) △H。下列说法正确的是( )
A.△H═3△H1+△H2+2△H3+2△H4
B.催化剂能够有效降低反应的活化能并改变反应的焓变
C.反应①和总反应均为放热反应
D.增大压强和使用高效催化剂均有利于提高反应②③④的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
实验编号 | HA物质的量浓度/(molL-1) | NaOH物质的量浓度/( molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.2 | pH=a |
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____。
(2)②组中c_____0.2(填“>”、“<”或“=”,下同);③组中 a_____9。
(3)常温下,HA 的电离平衡常数的值为_____。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H2C2O4的电离平衡常数Ka1= 5.9 ×10 -2,K a2= 6.4 ×10 -5,用0.100 0 molL-1 NaOH溶液滴定20.00 mL 0.100 0 molL-1H2C2O 4溶液的曲线如图所示(体积变化忽略不计)。下列说法正确的是
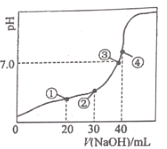
A.滴定过程中,当 pH=4 时,存在:c(H+)+c(Na+ )=c(OH- )+c(![]() )+c(
)+c(![]() )
)
B.点①、③、④所示溶液中,点③所示溶液水的电离程度最大
C.点③所示溶液:3c(![]() )+2c(
)+2c(![]() )+c(H2C2O4)=0.l molL-1
)+c(H2C2O4)=0.l molL-1
D.滴定过程中可能出现:c(Na+)>c(![]() )= c(
)= c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
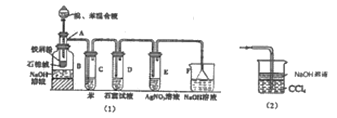
【题目】图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
A.苯和液溴在A中发生反应的化学方程式为:![]() +Br2
+Br2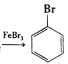 +HBr
+HBr
B.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。

向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为__。
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为__。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率__(填“增大”“减小”或“不变”,下同);HF的平衡浓度__。
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=__,该反应的平衡常数K=__。
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的H__0(填“>”“<”或“=”,下同)。a_1,理由为__。
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的H__0(填“>”“<”或“=”,下同)。a_1,理由为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能________B(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为________(用元素符号表示)。
(2)D元素原子的价电子排布式是________。
(3)C元素的电子排布图为________________;E3+的离子符号为________________。
(4)F元素位于元素周期表的________区,其基态原子的电子排布式为________________。
(5)G元素可能的性质________。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一定条件下的化学平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.恒温恒容,充入H2,v(正)增大,平衡右移
B.恒温恒容,充入He,v(正)增大,平衡右移
C.加压,v(正),v(逆)不变,平衡不移动
D.升温,v(正)减小,v(逆)增大,平衡左移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com