
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 将干燥的Cl2通过有色鲜花 | 鲜花褪色 | Cl2有漂白性 |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.气体为二氧化碳或二氧化硫等;
B.干燥的氯气不具有漂白性;
C.滴加氯水和CCl4,振荡,下层为紫色,则氯气氧化碘离子生成碘单质;
D.过氧化钠与水反应生成氧气.
解答 解:A.气体为二氧化碳或二氧化硫等,则溶液中可能含有CO32-或SO32-,或HCO3-等,故A错误;
B.干燥的氯气不具有漂白性,HClO具有漂白性,结论不合理,故B错误;
C.滴加氯水和CCl4,振荡,下层为紫色,则氯气氧化碘离子生成碘单质,则原溶液中有I-,故C正确;
D.过氧化钠与水反应生成氧气,变质生成的碳酸钠与盐酸反应生成二氧化碳,则不能检验是否变质,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握离子的检验、物质的性质、物质的检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca(OH)2+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
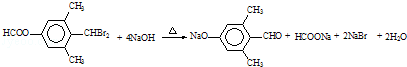
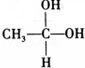 →CH3-CHO+H2O
→CH3-CHO+H2O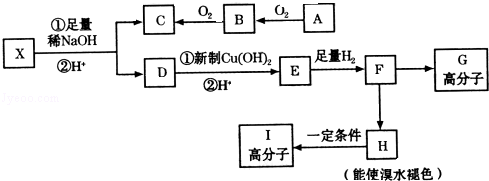
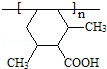 .
. .
.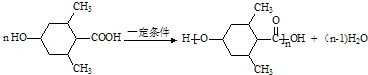 .
.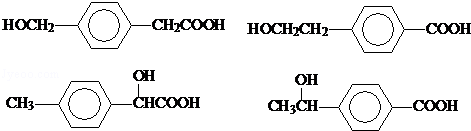 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是指物质的多少 | |
| B. | 原子、电子、中子、桌子等都可用物质的量来描述 | |
| C. | 物质的量是用来描述微观粒子的基本单位之一 | |
| D. | 物质的量是以摩尔为单位计量微粒数目的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气 | |
| C. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
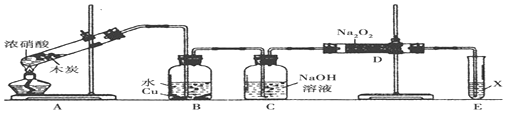
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
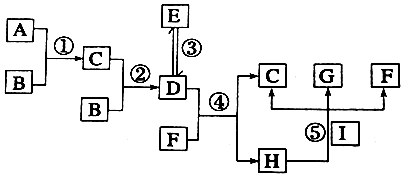
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com