
下列实验操作正确的是
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCI溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
B.原子半径:Z>Y>X
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1︰2
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列鉴别方法不可行的是
A.用水鉴别1-丙醇、甲苯和硝基苯
B.用燃烧法鉴别甲醇、苯和四氯化碳
C.用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用溴水鉴别乙苯、苯酚、环己烷和乙醇
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一。Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,有关该电池的下列说法中,正确的是
A.电池反应的化学方程式为:2Li+FeS=Li2S+Fe
B.负极的电极反应式为:Al-3e-=Al3+
C.Li—Al在电池中作为负极材料,该材料中Li的化合价是+1
D.电池充电时,阴极反应为:Li2S+Fe-2e-=2Li++FeS
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:填空题
(14分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。
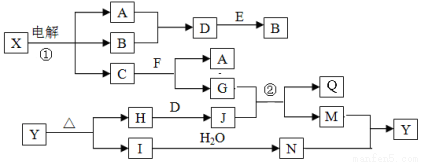
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质:E、H、I为氧化物,E为黑色固体,H为红棕色粉末,I为红棕色气体;M为红褐色沉淀,Q为白色胶状物质。
请回答下列问题:
(1)组成单质F的元素在周期表中的位置是______;C中存在的化学键类型为____;E的化学式是___。
(2)A在B中燃烧的现象是_______ 。
(3) D+E→B的反应中,被氧化与被还原的物质的物质的量之比是_______。
(4)反应①的化学方程式为___________________________________ 。
(5)反应②的离子方程式为___________________________________。
(6)Y受热分解可生成H、I和氧气,.写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三毕业班联考二理综化学试卷(解析版) 题型:填空题
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+) > > > >c(OH-) 。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:简答题
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列各组物质,按化合物、单质、混合物顺序排列的是
A.干冰、 铁、 冰水 B.烧碱、液态氧、氯水
C.生石灰、白磷、熟石灰 D.黄铜、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是
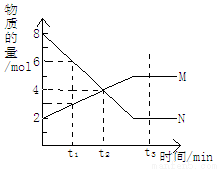
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com