
【题目】氮是地球上含量比较丰富的一种元素,氮的化合物在工业生产和生活中有重要的作用。
I.已知298K时,发生反应:N2O4(g) ![]() 2NO2(g)
2NO2(g)
(1)反应达到平衡后,压缩容器的体积,再次达到平衡时混合气体的颜色 ____(填“变深”、“变浅”或“不变”)。
(2)恒容密闭容器中发生上述反应,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=___________(用k正、k逆表示)。若初始压强为100kPa,k正=2.8×104s-1,当NO2的体积分数为40%时,v正=__________kPa·s-1。[其中p(N2O4)和p(NO2)分别是N2O4和NO2的分压,分压=p总×气体体积分数,k正、k逆为速率常数]
Ⅱ.在催化剂作用下,H2可以还原NO消除污染,反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=akJ·mol-1
N2(g)+2H2O(g) △H=akJ·mol-1
(3)若每生成7g N2放出166kJ的热量,则a=____。
(4)该反应分两步进行:
①2NO(g)+H2(g)![]() N2(g)+H2O2(g) △H1
N2(g)+H2O2(g) △H1
②H2O2(g)+H2(g)![]() 2H2O(g) △H2
2H2O(g) △H2
已知:i.总反应分多步进行时,较慢的一步决定总反应速率;
III.总反应的速率表达式v=kc2(NO)·c(H2)(k为速率常数,只和温度有关)。由上述信息可知,正反应的活化能较低的是____(填“①”或“②”)。
(5)将2molNO和1molH2充入一个恒容的密闭容器中,经相同时间测得N2的体积分数与温度的关系如图所示。低于900K时,N2的体积分数_____(填“是”或“不是”)对应温度下平衡时的体积分数,原因是_____。高于900K时,N2的体积分数降低的可能原因是____。
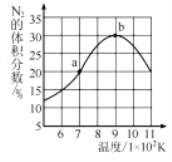
【答案】变深 ![]() 2.1×106 -664 ② 不是 该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低 催化剂的活性下降、升温平衡逆向移动、副反应增多等
2.1×106 -664 ② 不是 该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低 催化剂的活性下降、升温平衡逆向移动、副反应增多等
【解析】
(1)反应![]() 达到平衡后,压缩容器的体积,二氧化氮的浓度变大而使混合气体的颜色变深,虽然平衡会逆向移动,但是,根据平衡移动原理可知,再次达到平衡时混合气体的颜色仍比原平衡深,故答案为:变深;
达到平衡后,压缩容器的体积,二氧化氮的浓度变大而使混合气体的颜色变深,虽然平衡会逆向移动,但是,根据平衡移动原理可知,再次达到平衡时混合气体的颜色仍比原平衡深,故答案为:变深;
(2)反应达到平衡状态,v正=v逆,即k正·p(N2O4)=k逆·p2(NO2),将其变式可得 ,设起始时N2O4的物质的量为1mol,列三段式有:
,设起始时N2O4的物质的量为1mol,列三段式有:
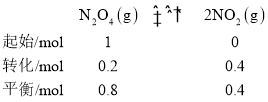
则![]()
v正=k正·p(N2O4)= 2.8×104s-1×75kPa=2.1×106kPa·s-1,故答案为:![]() ;2.1×106;
;2.1×106;
(3)由生成7g(0.25mol)N2放出166kJ的热量,可知,生成1molN2放出166×4=664kJ的热量,则a=-664,故答案为:-664;
(4)由总反应的速率表达式v=kc2(NO)·c(H2)可知,NO只出现在第①步反应,故第①步反应决定总反应速率,则①为慢反应,其正反应的活化能较高,则反应②的活化能较低,故答案为:②;
(5)由(3)可知,反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g),正反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低。由图像可知,N2的最大体积分数对应的温度为900K,当低于900K时, N2的体积分数随着温度的升高而增大,所以在此温度范围内N2的体积分数不是对应温度下平衡时的体积分数。当温度高于900K时,催化剂的活性下降、升温平衡逆向移动,或者副反应增多,从而使得N2的体积分数降低,故答案为:不是;该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低;催化剂的活性下降、升温平衡逆向移动、副反应增多等。
N2(g)+2H2O(g),正反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低。由图像可知,N2的最大体积分数对应的温度为900K,当低于900K时, N2的体积分数随着温度的升高而增大,所以在此温度范围内N2的体积分数不是对应温度下平衡时的体积分数。当温度高于900K时,催化剂的活性下降、升温平衡逆向移动,或者副反应增多,从而使得N2的体积分数降低,故答案为:不是;该反应为放热反应,平衡时N2的体积分数应随着温度的升高而降低;催化剂的活性下降、升温平衡逆向移动、副反应增多等。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.炭粉上发生的反应为:O2+4e-+4H+=2H2O
D.吸收氧气的过程中,铁作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。下列由此得出的说法中,错误的是
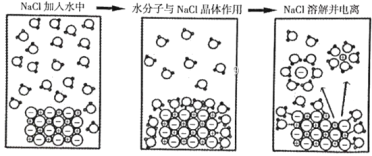
A.在H2O分子中,H或O原子均完全不带电荷
B.在NaCl晶体中,Na+和Cl-的排列整齐有序
C.Na+、Cl![]() 在水中是以水合离子的形式存在
在水中是以水合离子的形式存在
D.NaCl晶体的溶解和电离过程破坏了离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是
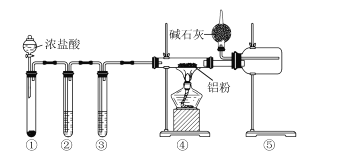
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.点燃④处酒精灯之前需排尽装置中的空气
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别向20mL浓度均为xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中![]() 和
和![]() 与AgNO3溶液的体积关系如图所示。下列说法不正确的是
与AgNO3溶液的体积关系如图所示。下列说法不正确的是
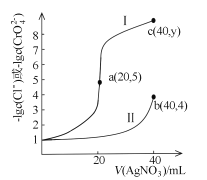
A.x =0.1B.曲线I代表NaCl溶液
C.Ksp(Ag2CrO4)约为4×10-12D.y=9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水处理在工业生产和科学实验中意义重大,处理方法很多,其中离子交换法最为简单快捷,如图是净化过程原理。有关说法中正确的是( )
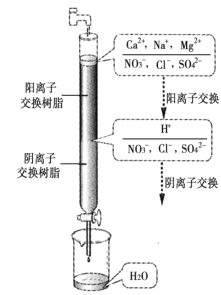
A.经过阳离子交换树脂后,水中阳离子的总数未发生变化
B.通过阳离子交换树脂时,H+则被交换到水中
C.通过净化处理后,水的导电性不变
D.阳离子树脂填充段存在反应H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成胃酸分泌调节剂的药物中间体,其合成路线流程图如图:
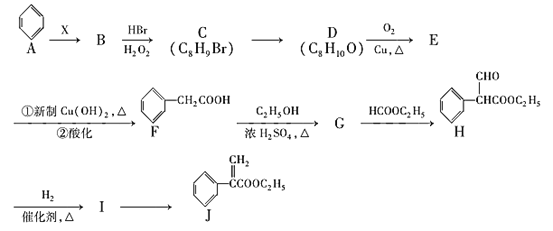
已知B为烃,其中含碳元素的质量分数为92.31%,其相对分子质量小于110。回答下列问题:
(1)H的官能团名称是__。
(2)X的名称为__。
(3)I→J的反应条件为__;A→B的反应类型为__。
(4)B分子中最多有__个碳原子在一条直线上。
(5)化合物I的多种同分异构体中,同时满足下列条件的同分异构体有__种。
①能发生水解反应和银镜反应②能与FeCl3溶液发生显色反应③苯环上有四个取代基,且苯环上一卤代物只有一种。其中,核磁共振氢谱有5组吸收峰物质的结构简式为__(任写一种即可)。
(6)参照上述合成路线,写出由F、甲醇、甲酸甲酯为有机原料制备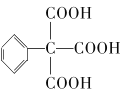 的合成路线流程图___(无机试剂任选)。
的合成路线流程图___(无机试剂任选)。
(7)酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
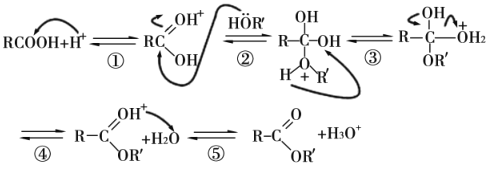
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯(![]() )的反应历程:
)的反应历程:
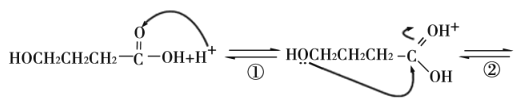 __。
__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的4位科学家,其研究对象之一为“分子开关”,即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图I所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子的核外电子排布式____。

(2)对于叔丁基杯[4]芳烃由4个羟基构成杯底,羟基中氧原子的杂化方式为____,羟基间的相互作用力为_____。
(3)已知C60分子结构和C60晶胞示意图如图所示:
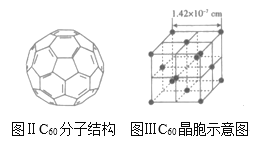
则1个C60分子中含有的![]() 键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com