
分析 在一密闭的2L容器中装有4mol SO2和2mol O2,2min末测得容器中共有5.2mol 气体,设消耗的O2的物质的量为x,则利用三段式法进行计算
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2x x 2x
2min末(mol):4-2x 2-x 2x
(1)根据c=$\frac{n}{V}$计算SO3的浓度;
(2)根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算v(O2);
(3)SO2的转化率=$\frac{转化的量}{起始的量}$×100%.
解答 解:(1)在一密闭的2L容器中装有4mol SO2和2mol O2,2min末测得容器中共有5.2mol 气体,设消耗的O2的物质的量为x,则利用三段式法进行计算:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2x x 2x
2min末(mol):4-2x 2-x 2x 4-2x+2-x+2x=5.2,解得x=0.8,则2min末SO3气体的物质的量2×0.8mol=1.6mol,
2min末SO3气体的物质的量浓度c(SO3)=$\frac{n}{V}$=$\frac{1.6mol}{2L}$=0.8mol/L,
答:2min末SO3气体的物质的量浓度为0.8mol/L;
(2)2min内O2的物质的量的变化为:0.8mol,2min内O2的平均反应速率v(O2)=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L•min),
答:2min内O2的平均反应速率v(O2)为0.2mol/(L•min);
(3)2min末变化的SO2的物质的量为2×0.8mol=1.6mol,SO2的转化率=$\frac{转化的量}{起始的量}$×100%=$\frac{1.6mol}{4mol}$=40%.
答:2min末SO2的转化率为40%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法及反应速率公式、转化率计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
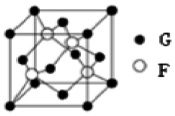 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
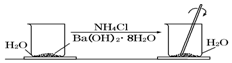 在研究化学反应中的能量变化时,我们通常做下面的实验:
在研究化学反应中的能量变化时,我们通常做下面的实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
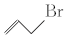 .则关于有机物
.则关于有机物  的说法正确的有( )
的说法正确的有( )| A. | 与苯互为同分异构体 | B. | 其二氯代物有3种 (不考虑立体异构) | ||
| C. | 分子中所有的碳原子在同一平面上 | D. | 属于烯烃,是乙烯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( )
为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( )| A. | 曲线Ⅱ对应的条件改变是增大压强 | |
| B. | T2℃时,上述反应平衡常数为0.52,则T2>T1 | |
| C. | 在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强P1>$\frac{{P}_{0}}{2}$ | |
| D. | 在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以淀粉为原料可以制取乙酸乙酸 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | 乙酸中所有原子可能处于同一平面 | |
| D. | 分子式为C3H6Cl2的同分异构体有5种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目相同 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图:
酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图: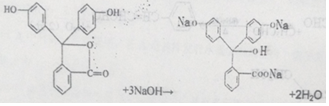 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com