
5.3g Na2CO3能与0.1 mol/L的盐酸________ mL完全作用,若该Na2CO3中混和K2CO3,则消耗的盐酸的量比纯Na2CO3时要________(填“多”或“少”)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
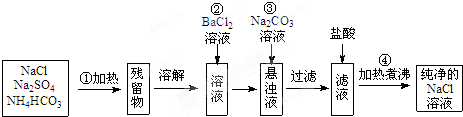
查看答案和解析>>
科目:高中化学 来源: 题型:
| 假 设 | 实验方案 | 实验结论 | |
| 甲同学 | 酸性: H2CO3>C6H5OH |
取少量苯酚放入试管,加过量NaOH溶液得澄清溶液,冷却至室温,再通入一段时间CO2,冷却至室温,观察未出现浑浊 | 通入CO2未见浑浊说明CO2不能与C6H5ONa反应,假设错误 |
| 乙同学 | 酸性: C6H5OH>HCO3- |
方案(一):在苯酚的乳浊液中加一定量的Na2CO3固体,Na2CO3固体溶解,苯酚乳浊液变清,无气泡生成.放置冷却,再观察,混合物仍然澄清. 方案(二):在苯酚的乳浊液中加一定量的饱和Na2CO3溶液,乳浊液变清,无气泡生成. |
方案一结论:假设正确 方案二结论:假设正确 |
| 提出假设 | 实验方案和预测现象 |
| ① |
② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在两支试管中分别加入3mL同浓度的稀盐酸,将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3和Na2CO3粉末同时倒入试管中,(如图),观察反应现象:
在两支试管中分别加入3mL同浓度的稀盐酸,将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3和Na2CO3粉末同时倒入试管中,(如图),观察反应现象:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com