
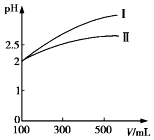
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 右边电极上生成物质的质量:①=② | |
| B. | 两级上产生气体的体积:①<② | |
| C. | 溶液的pH变化:①增大,②不变 | |
| D. | 电极反应式:①中阳极2H2O-4e-=4H++O2↑②中负极2H+-2e-=H2↑ |
分析 ①有外接电源,所以是电解池,阳极反应为4OH--4e-=O2↑+2H2O,阴极反应为:Cu2++2e-=Cu,②为原电池,正极反应为2H++2e-=H2↑,负极反应为Zn-2e-=Zn2+,以此解答该题.
解答 解:A、①右边电极阴极生成铜,反应为:Cu2++2e-=Cu;②右边电极为正极生成氢气,反应为2H++2e-=H2↑,则导线中均通过0.01mol电子,所以电极上析出物质的物质的量:①=②,故A错误;
B、①的阳极反应:4OH--4e-=O2↑+2H2O,导线中通过0.01mol电子时,产生氧气的体积V=nVm=0.01mol×$\frac{1}{4}$×22.4L/mol=0.0056L,②中的正极反应为:2H++2e-=H2↑,导线中通过0.01mol电子时,产生氢气的体积V=nVm=0.01mol×$\frac{1}{2}$×22.4L/mol=0.0112L,所以产生气体的体积:①<②,故B正确;
C、①相当于电解硫酸铜,溶液的pH减小,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C错误;
D、①中阳极反应为4OH--4e-=O2↑+2H2O,②中的负极:Zn-2e-═Zn2+,故D错误.
故选B.
点评 本题是一道有关原电池和电解池的工作原理的综合题目,要求学生熟悉教材基本知识,具备分析和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | Ka=l.8×l0-5 | Ka=4.9×10-10 | Kal=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨水、碱石灰都是混合物 | |
| B. | 将Na单质长时间的放置于空气中,最终得到的白色固体是NaHCO3 | |
| C. | SiO2不能溶于水生成H2Si03,因此SiO2不是酸性氧化物 | |
| D. | 用焰色反应检验Na+之前,应用稀硫酸清洗铁丝,并在火焰上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
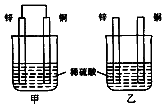
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
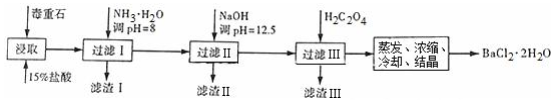
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
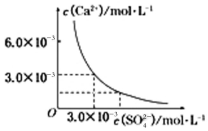
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com