
分析 (1)水为弱电解质,电离出水合氢离子和氢氧根离子;使水的电离平衡向右移动,应根据水的电离吸热、酸和碱抑制水的电离而盐类的水解促进水的电离来分析;
(2)在电解中,阳极如果是金属电极,那么是金属失电子,生成金属阳离子;向阴极作定向移动的是溶液中的阳离子,氢离子得到电子生成氢气,那么溶液中有了氢氧根离子,氢氧根离子和阳极产生的铜离子反应,生成氢氧化铜.
解答 解:(1)水为电解质,水的电离方程式为:2H2O?H3O++OH-;
若水的电离平衡向右移动,说明水的电离程度增大,
A.加入NaHSO4固体,由于NaHSO4是强电解质,能完全电离为钠离子、氢离子和硫酸根,使溶液中的氢离子浓度增大,故对水的电离有抑制作用,水的电离平衡左移,故A错误;
B.加入金属钠,钠与水电离的氢离子反应,水的电离平衡向右移动,故B正确;
C.由于水的电离吸热,故加热至100℃,水的电离程度增大,平衡右移,故C正确;
D.通入氨气,一水合氨电离出氢氧根离子,溶液显示碱性,抑制了水的电离,水的电离被抑制,故D错误;
故答案为:2H2O?H3O++OH-;BC;
(2)电解硫酸铜溶液时,阳极:Cu-2e-=Cu2+,阴极:2H++2e-=H2↑,用铜作电极电解硫酸铜溶液的离子方程式为:Cu+2H2O $\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,
故答案为:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cu(OH)2↓+H2↑.
点评 本题考查了水的电离平衡的移动以及电解方程式的书写,应注意的是酸和碱抑制水的电离而盐类的水解促进水的电离.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
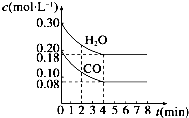 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 在1L 0.5 mol/L的盐酸加入1.5 mol/L盐酸1L | |
| D. | 从1000mL 1mol/LNaCl溶液中取出100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯的结构简式: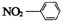 | B. | CO2分子比例模型: | ||
| C. | HClO的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | B. | 所得的分散系中的分散质为Fe2O3 | ||
| C. | 给分散系通电时阳极周围黑色不变 | D. | 该分散系能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com