
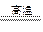 CO(g)+H2(g),△H =" +131.4" kJ ·mol-1
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO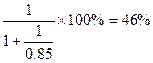
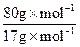 =216kg
=216kg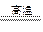 CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。 2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。 ,所以中和硝酸所需的氨占总的氨消耗量的分数为
,所以中和硝酸所需的氨占总的氨消耗量的分数为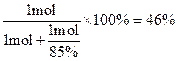 。
。 =216kg。
=216kg。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M具有很高的熔沸点 |
| B.M容易汽化,可用作制冷材料 |
| C.M和干冰互为同素异形体 |
| D.M是由C原子和O原子按1∶2的比例所组成的平面网状的晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KCl | B.K2SO4 |
| C.KNO3 | D.K2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 4NO+6H2O,②4NO+3O2+2H2O====4HNO3。设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入100 mL水,得到溶液。
4NO+6H2O,②4NO+3O2+2H2O====4HNO3。设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入100 mL水,得到溶液。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气体使湿润的酚酞试液变红 | B.气体能使湿润的红色石蕊试纸变蓝 |
| C.气体与蘸有浓H2SO4的玻璃棒靠近 | D.气体与蘸有浓盐酸的玻璃棒靠近 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氮气 | B.氨气 | C.硝酸钠 | D.氯化铵 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下使品红溶液褪色的气体一定是SO2 |
| B.常温下使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
| C.常温下使湿润的红色石蕊试纸变蓝的气体一定是NH3 |
| D.常温下使溴的四氯化碳溶液褪色的气体一定是C2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com