
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
分析 KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7-2)=4a+2b,整理得a+b=0.5-a,当高氯酸钾没有分解时,(a+b)达极大值,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定(a+b)的最小值.
解答 解:KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7-2)=4a+2b,整理得a+b=0.5-a,
当高氯酸钾没有分解时,即a=0,(a+b)达极大值,故(a+b)<0.5,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol×$\frac{1}{2}$=0.1mol,故a+b≥0.5-0.1=0.4,
故选:C.
点评 本题考查混合物计算、氧化还原反应计算,注意充分利用整个过程中的电子转移守恒解答,关键是用氧气物质的量表示出m的表达式.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
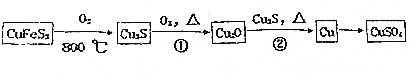
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
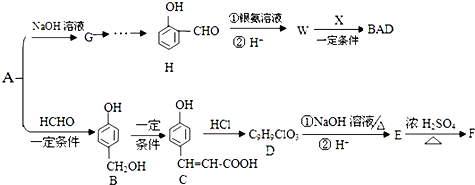
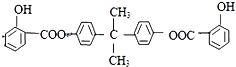
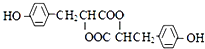
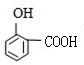 .
.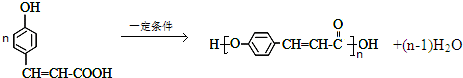 .
. .
.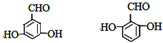 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
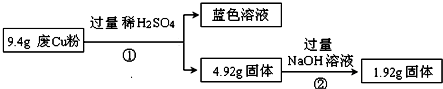

| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白炽灯工作时,电能全部转化为光能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化热能 | |
| D. | 电解水生成H2和O2时,电能主要转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素原子中共有25个电子 | B. | 该元素原子核外有4个能层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M电子层共有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质均属于天然高分子化合物,水解产物都只有一种 | |
| B. | 油脂在碱性条件下水解属于皂化反应,酸性条件下的水解产物为甘油和高级脂肪酸 | |
| C. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| D. | TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O↓+4HCl 属于水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com