
已知:HNCO(异氰酸,其结构是H-N=C=O)能和NO2反应生成N2、CO2和H2O。下列有关上述反应的叙述不正确的是
A. HNCO中的氮元素被氧化 B. NO2中的氮元素被还原
C.每生成1mol H2O转移6mol电子 D. CO2是氧化产物
【知识点】氧化还原反应规律B2 B3
【答案解析】D 解析:由结构式H-N=C=O知HNCO中H为+1价,N为-3价,C为+4价,O为-2价,反应中只有N元素的化合价发生变化,反应方程式为8HNCO+6NO2=7N2+8CO2+4H2O,则
A.HNCO中N为-3价,反应后N为0价,则HNCO中的氮元素被氧化,故A正确;
B.NO2中N为+4价,反应后N为0价,则NO2中的氮元素被还原,故B正确;
C.根据方程式可知,生成4mol水转移24mol电子,则每生成1mol H2O转移6mol电子,故C正确;
D.反应中只有N元素的化合价发生变化,N2既是氧化产物,又是还原产物,故D错误.
故答案选D
【思路点拨】本题考查了氧化还原反应规律,解题的关键是利用HCNO的结构式判断元素的化合价。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是( )
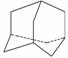
A.4种 B.6种
C.8种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量
(填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 (该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题。
(1) 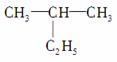 命名为“2乙基丙烷”,错误原因是____________________;将
命名为“2乙基丙烷”,错误原因是____________________;将
其命名为“3甲基丁烷”,错误原因是__________________。正确的命名为________。
(2)  的名称是________________。
的名称是________________。
(3)2,6二甲基4乙基辛烷的结构简式是______________________,1 mol该烷烃完全燃烧需消耗氧气______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
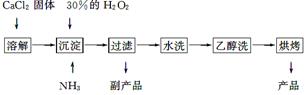
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从硫化物中提取单质锑,经历以下两个过程: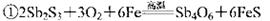
②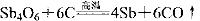 关于反应①、②的说法不正确的是
关于反应①、②的说法不正确的是
A.反应①中Sb元素被氧化
B.反应②中Sb元素被还原
C.标准状况下,每生成4 mol Sb时,消耗67.2LO2
D.反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.将“地沟油”制成肥皂,可以提高资源的利用率
C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com