
如图所示,下列说法不正确的是( )
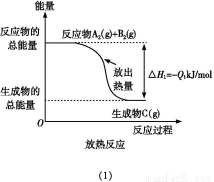

A.反应过程(1)的热化学方程式为A2(g)+B2(g)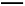 C(g)ΔH1=-Q1 kJ/mol
C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)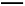 A2(g)+B2(g)ΔH2=+Q2 kJ/mol
A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:选择题
X、Y、Z、W为短周期主族元素,原子序数依次增大,X的族序数是周期数的2倍,Y的气态氢化物与最高价氧化物水化物可形成盐,Z的最外层电子数与其电子总数比为3∶8,下列说法正确的是( )
A.X、Y、W的最高价含氧酸酸性顺序:Y>W>X
B.Z、W可形成ZW2的化合物,属于离子化合物
C.离子半径:Z>W>Y
D.气态氢化物的稳定性:Z>W
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 电解质溶液练习卷(解析版) 题型:选择题
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(C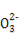 )均增大
)均增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
下列有关实验原理、方法、操作或结论不正确的是( )
A.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
B.用水湿润pH试纸测量某溶液的pH,一定会产生实验误差
C.容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须用所盛溶液润洗几次后方可使用
D.称取a克Na2CO3和NaHCO3混合物充分加热,减重b克,可测定混合物中Na2CO3的质量分数
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
以下关于化学实验中“先与后”的说法中不正确的是( )
A.使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
B.做H2还原CuO实验时,先通H2后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2
C.点燃可燃性气体如H2、CH4、C2H4、C2H2等时,先检验气体纯度后点燃
D.用排水法收集气体后,先撤酒精灯后移出导管
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性 锌锰电池 | 图Ⅱ 铅 酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为常见的10电子分子。下列说法不正确的是( )
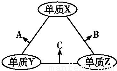
A.X元素位于ⅥA族
B.A不能溶解于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
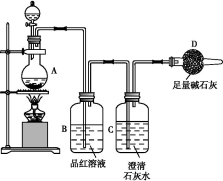
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
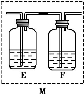
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn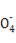 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。
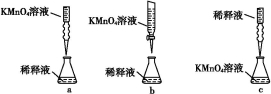
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com