
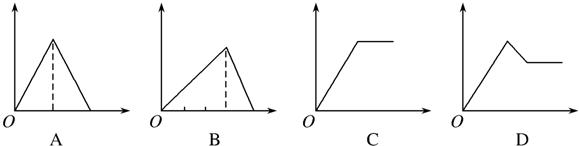
分析 (1)饱和AlCl3溶液中滴入稀氨水生成沉淀氢氧化铝,氢氧化铝不溶于弱碱氨水;
(2)饱和AlCl3溶液中滴加NaOH溶液,生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠溶液反应而溶解;
(3)氢氧化钙通入二氧化碳,先反应生成碳酸钙沉淀,然后碳酸钙与二氧化碳和水反应生成碳酸氢钙而溶解;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,生成两种沉淀:氢氧化镁和氢氧化铝,随着反应的进行沉淀量增大,但氢氧化铝溶于强碱,氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,沉淀会部分溶解.
解答 解:(1)向饱和AlCl3溶液中滴加氨水至过量,发生反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,一水合氨属于弱碱,氢氧化铝不溶于弱碱,所以沉淀的质量不变,图象C符合该过程;
故答案为:C;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)饱和AlCl3溶液中滴加NaOH溶液,首先发生反应:Al3++3OH-═Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+OH-═AlO2-+2H2O,沉淀溶解,根据方程式可知:1molAlCl3反应,生成沉淀和沉淀溶解,消耗的NaOH的物质的量分别为3mol和1mol,图象B符合该过程;
故答案为:B;Al(OH)3+OH-═AlO2-+2H2O;
(3)饱和石灰水通过量CO2气体,首先发生反应生成碳酸钙:Ca2++2OH-+CO2=CaCO3↓+H2O,然后碳酸钙与二氧化碳反应,沉淀溶解:CaCO3+CO2+H2O=Ca2++2HCO3-,生成沉淀和沉淀溶解所用CO2相等,图象A符合该过程;
故答案为:A;Ca2++2OH-+CO2=CaCO3↓+H2O;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,发生反应:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,但氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,然后发生 Al(OH)3+OH-═AlO2-+2H2O,随着氢氧化钠溶液的加入,沉淀量减少,但不会完全溶解,图象D符合该过程;
故答案为:D;Mg2++2OH-═Mg(OH)2↓.
点评 本题考查了离子方程式的书写,熟悉反应的实质,明确图象的含义是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳与二氧化碳反应 | |
| B. | 碳酸钙的分解 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 葡萄糖在人体中转化成二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 运用碳及其化合物的性质,完成下列小题:
运用碳及其化合物的性质,完成下列小题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 甲烷的标准燃烧热△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯(C6H5CH=CH2)中含有的碳碳双键数目为4NA | |
| B. | 加热条件下,MnO2与浓盐酸反应生成7.1gCl2,转移的电子数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| D. | 常温下,1L0.1mol•L-1的CH3COOH溶液中含有的H+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 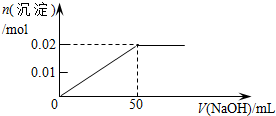 | B. |  | ||
| C. | 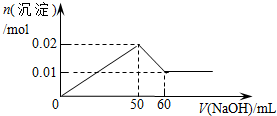 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
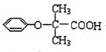
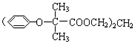 ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: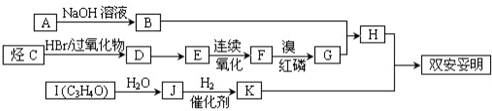
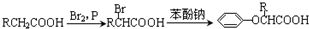
 .
. .
.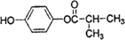 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com