
| A、增大pH |
| B、加入2.0 mol?L-1NH4Cl固体 |
| C、加入MgSO4,固体 |
| D、加入适量95%乙醇 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
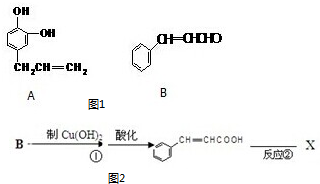
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
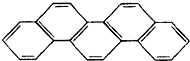 有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是( )| A、该烃属于烯烃 |
| B、该烃分子中只含非极性键 |
| C、该烃的二氯代物只有一种 |
| D、该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
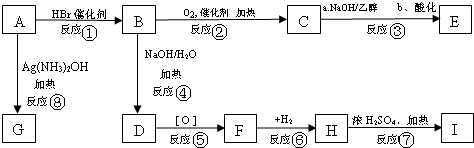
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Br-、CrO42- |
| B、CrO42-、Br-、Cl- |
| C、Br-、Cl-、CrO42- |
| D、Br-、CrO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92 kJ?mol-1 |
| B、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18 kJ?mol-1 |
| C、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73 kJ?mol-1 |
| D、Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com