
| A. | 第六周期ⅣA族 | B. | 第六周期ⅢB族 | C. | 第七周期0族 | D. | 第六周期ⅢA族 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
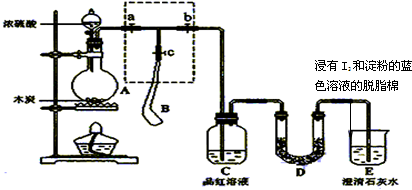
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离原子核越远 | |
| B. | 核外电子的分层排布即是核外电子的分层运动 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 当M层是最外层时,最多可排18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入浓溴水,出现白色沉淀,说明含有苯酚 | |
| B. | 向含酚酞的氢氧化钠溶液中加入溴乙烷,加热后红色变浅,说明溴乙烷发生了水解 | |
| C. | 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余 | |
| D. | 将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、
、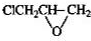 .
. 分子式相同,且能使氯化铁溶液显紫色的同分异构体还有11种(不考虑立体异构),其中核磁共振氢谱为4组峰,且峰的面积比为2:2:1:3的结构简式(写出其中任意两种)是
分子式相同,且能使氯化铁溶液显紫色的同分异构体还有11种(不考虑立体异构),其中核磁共振氢谱为4组峰,且峰的面积比为2:2:1:3的结构简式(写出其中任意两种)是 、
、 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com