
| 3 |
| 73 |
| 3 |
| 73 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )
大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )| A、△H=E2-E3 |
| B、E1-E3=△H1+△H2 |
| C、氯原子可使E1减少 |
| D、2O2═O3+O是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含2mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA |
| B、30g二氧化硅晶体中含有0.5NA个二氧化硅分子 |
| C、金刚石晶体中,碳原子数与C-C键数之比为1:2 |
| D、晶体硅、晶体氖均是由相应原子直接构成的原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:
在体积为3L的密闭容器中,CO和H2在一定条件下反应生成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CO2) |
| n(H2) |
| 设备编号 | c(CO2) /mol?L-1 | c(H2) /mol?L-1 | c(CH3OCH3) /mol?L-1 | c(H2O) /mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
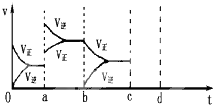 如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是
如图表示在密闭容器中反应:CO2(g)+C(s)?2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com