
| A. | 氢氧化钡溶液中加入少量稀硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | NaClO(aq)中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
分析 A.不符合离子的配比;
B.发生氧化还原反应生成硫酸钠;
C.生成的HClO在离子反应中保留化学式;
D.反应生成碳酸钙、HClO.
解答 解:A.氢氧化钡溶液中加入少量稀硫酸的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.NaClO(aq)中通入过量 SO2的离子反应为C1O-+SO2+H2O=2H++Cl-+SO42-,故B错误;
C.氯气通入水中的离子反应为Cl2+H2O=H++Cl-+HClO,故C错误;
D.次氯酸钙溶液中通入少量CO2的离子反应为Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:实验题
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E 溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1mol A的溶液与含1m ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
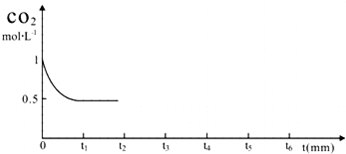
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
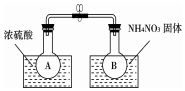 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向逆反应方向移动了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.9g/mol | B. | 26 | C. | 26 g/mol | D. | 29.3 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
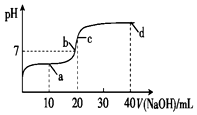 室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )| A. | a点:c(HA)>c(A-) | B. | b点:c(Na+)=c(A-)+c(HA) | ||
| C. | c点:c(H+)+c(HA)=c(OH-) | D. | d点:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
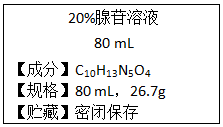 根据腺苷的相关信息,计算下列各题:
根据腺苷的相关信息,计算下列各题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com