
向一定量Fe、Fe2O3的混合物中加入250 mL 2 mol·L-1的HNO3溶液,反应完成后生成1.12 L(标准状况下)NO气体,再向反应后溶液中加入1 mol·L-1 NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液体积最少是 ( )。
A.450 mL B.500 mL
C.400 mL D.不能确定
科目:高中化学 来源: 题型:
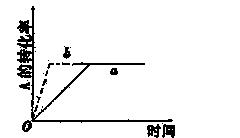
已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(g)(正反应为放热反应)。下图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是
( )
A、增大A的浓度 B、缩小容器的体积 C、加入催化剂 D、升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
.1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是 ( )
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. NO2和N2O4 的混合气体中,NO2 的体 积分数是80%
积分数是80%
D. 得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短 周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有
(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热
化学方程式:  。
。
(5)ZX的电子式为 ;ZX与水反应放出气体的化学方程式为 。
(6) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如右),反应原
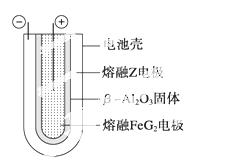
理为2Z+FeG2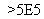 Fe+2ZG
Fe+2ZG
放电时,电池的正极反应式为  ;
;
充电时, (写物质名称)电极接电源的负极;该电池的电解质为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是
A. 钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e- =4OH一
=4OH一
B. 明矾水解的离子方程式: Al3++3 H2O Al(OH)3+3H+
Al(OH)3+3H+
C.少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+ HCO3一=H2O+ CO32-
D. 表示氢气燃烧的热化学方程式2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
由黄铜矿(主要成分是CuFeS2) 炼制精铜的工艺流程示意图如下:
炼制精铜的工艺流程示意图如下:
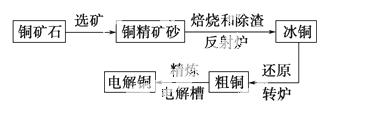
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是____________________、__________________________,反射炉内生成 炉渣的主要成分是________;
炉渣的主要成分是________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____________;
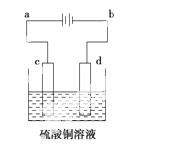
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为____________________________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com