
| A. | ①②④⑤ | B. | 全部 | C. | ②④⑤ | D. | ②③④⑤ |
分析 ①易引入水蒸气杂质;
②加热灼烧,可除去有机物;
③二者与饱和NaHSO3溶液都不反应;
④电解时活泼金属做阳极,金属失电子,锌离子进入溶液,银作为阳极泥析出;
⑤NaCl的溶解度受温度影响不大,但硝酸钾的溶解度受温度影响较大,则可利用结晶、重结晶来除去.
解答 解:①三氧化硫可被稀硫酸吸收,但易引入水蒸气杂质,应用浓硫酸,故错误;
②有机物燃烧生成水和二氧化碳,可用加热灼烧的方法除去有机物,故正确;
③二者与饱和NaHSO3溶液都不反应,应用饱和碳酸氢钠溶液除杂,故错误;
④电解时活泼金属做阳极,金属失电子,锌离子进入溶液,银作为阳极泥析出,故正确;
⑤NaCl的溶解度受温度影响不大,但硝酸钾的溶解度受温度影响较大,则可利用结晶、重结晶来除去KNO3中的NaCl杂质,故正确;
故选C.
点评 本题考查混合物分离、提纯的方法及应用,为高频考点,把握物质的性质、性质差异为解答的关键,注意分离方法的选择,侧重除杂的考查,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.500 mol | B. | 1.00 mol | C. | 0.125mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加过量的氨水:4NH3•H2O+Al3+═AlO2-+4NH4++2H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NH4++4OH-=Al(OH)3↓+NH3•H2O | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H4 | C. | C3H8 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
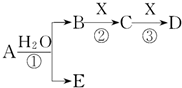 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) | |
| B. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com