
 流量比为y,请通过计算列出y与x的关系式.
流量比为y,请通过计算列出y与x的关系式.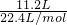 =0.5L,4.48L的CH4的物质的量为
=0.5L,4.48L的CH4的物质的量为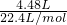 =0.2mol,令混合气体中NO2、NO的物质的量分别为xmol、ymol,则:
=0.2mol,令混合气体中NO2、NO的物质的量分别为xmol、ymol,则: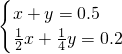
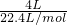 ×2.8,解得b=2.75,令+2Fe与+3价Fe的原子数目之比为m:n,根据平均化合价,则2m+3n=2.75m+2.75n,整理得m:n=1:3,氧化物化学式为aZnO?2FeO?3Fe2O3,化学式中n(Fe)=2n(Zn),故a=4,即氧缺位铁酸锌ZnFe2Oz的氧化物形式为4ZnO?2FeO?3Fe2O3,故答案为:4ZnO?2FeO?3Fe2O3;
×2.8,解得b=2.75,令+2Fe与+3价Fe的原子数目之比为m:n,根据平均化合价,则2m+3n=2.75m+2.75n,整理得m:n=1:3,氧化物化学式为aZnO?2FeO?3Fe2O3,化学式中n(Fe)=2n(Zn),故a=4,即氧缺位铁酸锌ZnFe2Oz的氧化物形式为4ZnO?2FeO?3Fe2O3,故答案为:4ZnO?2FeO?3Fe2O3;

 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| A | B | C | D | |
| 污染物 | 二氧化硫 | 甲醛 | 氮氧化物 | 悬浮颗粒物 |
| 来源 | 雷电时空气中产生 | 人造家具、用具 | 燃煤、汽车尾气 | 燃煤、施工 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
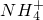
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 体积的氯气和
体积的氯气和 体积的甲烷气体,用灯光照射瓶中的混合气体.
体积的甲烷气体,用灯光照射瓶中的混合气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe2(SO4)3+3SO2↑+6H2O.请你参与探究并回答相关问题.
Fe2(SO4)3+3SO2↑+6H2O.请你参与探究并回答相关问题.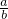 的取值范围是______;若反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则
的取值范围是______;若反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则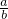 的值为______.
的值为______.
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com