
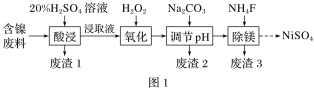
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
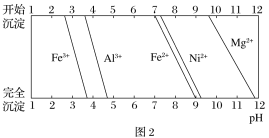
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有______________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。“氧化”步骤中加入H2O2的目的是____________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是____________(填化学式)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=____________(列出计算式即可) mol·L-1。NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=________ mol·L-1。
【答案】增加硫酸浓度或提高反应温度(合理即可) SiO2 2Fe2++2H++H2O2==2Fe3++2H2O Fe(OH)3、Al(OH)3 ![]() 酸性 2.0×10-3
酸性 2.0×10-3
【解析】
含镍废料酸浸时,生成硫酸镍、硫酸亚铁、硫酸铝、硫酸镁溶液,和不溶物为二氧化硅,则滤渣1为二氧化硅;根据图2沉淀表,则需氧化亚铁离子为铁离子后调节pH逐个除去杂质离子,用氟离子除去溶液中的镁离子。
(1)为提高浸出速率,粉碎原材料或升高温度或增大酸的浓度均可;
(2)废料中只有二氧化硅不溶于硫酸,则废渣1为二氧化硅;除亚铁离子的pH为7~9,与镍离子接近,则需氧化为铁离子除去,加入过氧化钠的目的为氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++2H++H2O2==2Fe3++2H2O;加Na2CO3调节溶液的pH至5,除去溶液中的铁离子、铝离子,生成氢氧化铁和氢氧化铝沉淀;
(3)1mol·L-1的NaF溶液中c(F-)=1mol/L,根据F-+H2OOH-+HF,c(OH-)=c(HF),c(OH-)×c(HF)=Kh×c(F-)=![]() ,则c(OH-)=
,则c(OH-)=![]() mol/L;已知25℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,NH4F相当于为强酸弱碱盐,溶液显酸性;
mol/L;已知25℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,NH4F相当于为强酸弱碱盐,溶液显酸性;
(4)当除镁率达到99%时,溶液中剩余c(Mg2+)=1.85×10-3×1%=1.85×10-5mol/L,c(Mg2+)×c2(F-)=Ksp(MgF2),则c2(F-)=![]() =4×10-6,c(F-)=2×10-3mol/L。
=4×10-6,c(F-)=2×10-3mol/L。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】用无水Na2CO3固体配制250mL 0.1000mol·L-1的溶液。请回答:
(1)在配制过程中用到的仪器是______(填序号)。
A.烧杯 B. 托盘天平 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)需要无水Na2CO3的质量______克。
(3)定容时的操作:当液面接近容量瓶刻度线________cm时改用__________(胶头滴管、烧杯、试管)再将容量瓶塞盖好,反复上下颠倒,摇匀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷灰石是一系列磷酸盐矿物的总称,主要指氟磷灰石[Ca5(PO4)3F],以氟磷灰石为原料可制备缓冲试剂磷酸二氢钾(KH2PO4),其工艺流程如图所示:
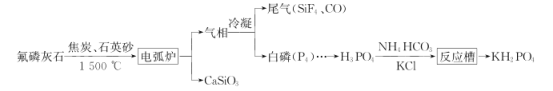
回答下列问题:
(1)电弧炉中发生反应的化学方程式:__。
(2)制得的白磷中常含有少量的砷,利用稀硝酸,可将砷转化为亚砷酸(H3AsO3)和砷酸(H3AsO4)而除去。使用质量分数为25%(密度为1.15g·cm-3)的硝酸效果最佳,此硝酸的质量摩尔浓度(单位质量的溶剂中所含溶质的物质的量)为__×10-3mol·g-1(保留一位小数),除砷过程中需要控制温度为75℃,且在高纯N2的保护下进行,温度不能过高的原因是__。
(3)反应槽中发生反应的离子方程式为__。
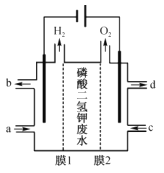
(4)通过如图电解系统可从磷酸二氢钾废水中提取磷酸和氢氧化钾。膜1为__(填“阳离子”或“阴离子”)交换膜,阳极电极反应式为__,转移0.15mol电子,理论上获得磷酸的质量为__g。
(5)自然界中Ca5(PO4)3OH与Ca5(PO4)3F存在如下平衡:Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=__,{已知:Ksp[Ca5(PO4)3OH]=7.0×10-37,Ksp[Ca5(PO4)3F]=2.8×10-61}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1的盐酸采用“双指示剂法"滴定25.00mL0.1000mol·L-1纯碱溶液,滴定曲线如图所示。下列说法正确的是( )
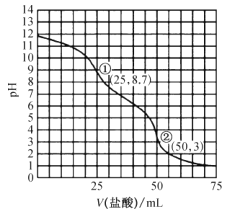
A.开始滴定到终点①过程应采用甲基橙作指示剂
B.由①到②的过程中会出现c(Na+)>2c(CO32-)+c (HCO3-)
C.滴定终点①处,水电离出的氢离子浓度约为10-8.7mol·L-1
D.滴定过程中含碳微粒的总浓度始终保持0.1000mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
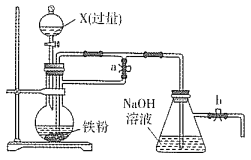
A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发酵法制酒精的过程可粗略表示如下:
①(C6H10O5)n+nH2O![]() nC6H12O6 ②C6H12O6
nC6H12O6 ②C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
(1)上述化学方程式中(C6H10O5)n可能表示_____ ____(填物质名称);
(2)C6H12O6名称是_________,常用_____ ____试剂来检验其存在;
(3)为检验苹果成熟过程中发生了反应①,可在青苹果汁中滴加碘酒,溶液呈_________色,向熟苹果汁中加入Cu(OH)2悬浊液,加热,反应生成____ ____(填实验现象);
(4)下列作用不属于水解反应的是_________
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
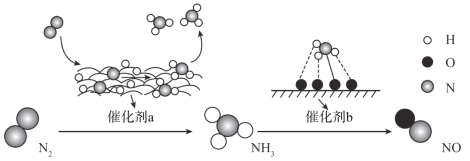
下列叙述正确的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均属于氮的固定
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com