


 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
 实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.
实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
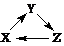 ”转化关系的一组是
”转化关系的一组是| X | Y | Z | |
| A | CH2=CH2 | CH3CH2OH | CH3CH2Br |
| B | CH3CH2OH | CH3CHO | CH3COOH |
| C | C | CO | CO2 |
| D | HNO3 | NO | NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1 |
| B、0.3mol?L-1 |
| C、0.42mol?L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、③⑥ | C、②⑥ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
,脱落酸属植物生长抑制剂,对该物质叙述正确的( )
| A、分子式为C15H22O4 |
| B、分子中所有碳原子可以在同一平面上 |
| C、1mol该物质最多可与3mol H2发生反应 |
| D、在一定条件下发生反应生成含七元环的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓HNO3在光照条件下变黄浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| B、K I淀粉溶液中通入适量Cl2,溶液变蓝Cl2能与淀粉发生显色反应 |
| C、向某溶液中加硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有SO42- |
| D、向盐酸中加入浓硫酸时产生白雾说明浓硫酸具有脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com