
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+ 立即被还原 成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是:
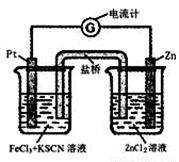
A.正极反应为Zn-2e-→Zn2+
B.左烧杯中溶液的红色变浅
C.Pt电极上有气泡出现
D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+
B
【解析】
试题分析:该原电池反应为Zn+2FeCl3=2FeCl2+ZeCl2,则负极为Zn,该反应不生成气体,阳离子移动到正极,左边烧杯中发生Fe3++e-=Fe2+,以此来解答。A、原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以该原电池的正极反应是Fe3++e-=Fe2+,负极反应为Zn-2e-=Zn2+,故A错误;B、左边烧杯中发生Fe3++e-=Fe2+,则左烧杯中溶液的红色逐渐褪去,故B正确;C、该原电池反应为Zn+2FeCl3=2FeCl2+ZeCl2,该反应不生成气体,故C错误;D、将正负极电极反应式合并即得到总反应为Zn+2FeCl3=2FeCl2+ZeCl2,故D不正确,答案选B。
考点:考查原电池原理的有关判断和应用


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
(2012?吉林一模)实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省吉林市高三上学期期末考试化学试卷 题型:选择题
实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如下图所示的原电池装置。下列有关说法中正确的是
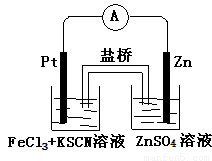
A.该原电池的正极反应是:Zn—2e-=Zn2+
B.左烧杯中溶液的红色逐渐褪去
 C.该电池铂电极上有气泡出现
C.该电池铂电极上有气泡出现
D.该电池总反应为:3Zn + 2Fe3+ = 2Fe + 3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com