
下列有关表述正确的是
A.加入催化剂不会使化学平衡移动
B.把封有NO2的烧瓶浸入热水中,颜色变浅
C.用30%的FeCl3溶液腐蚀印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+
D.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
AD
【解析】
试题分析:A.加入催化剂,使正反应速率增大的倍数与逆反应速率增大的倍数相同,因此化学平衡不会发生移动,正确;B.把封有NO2的烧瓶浸入热水中,平衡会向吸热反应方向移动,由于生成NO2的方向是吸热反应方向,所以混合气体颜色变深,错误;C.用30%的FeCl3溶液腐蚀印刷线路板上的铜箔:2Fe3+ + Cu=2Fe2+ + Cu2+,错误;D.过量的NaHSO4与Ba(OH)2溶液反应时应该以不足量的碱为标准来书写,离子方程式是:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,正确。
考点:考查影响化学平衡的移动的因素、盐的性质及离子方程式的书写的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三四月月考化学试卷(解析版) 题型:填空题
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1100 |
K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省高一第二学期期末化学试卷(解析版) 题型:选择题
仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+=Fe2++H2↑可分成氧化反应:Fe-2e-= Fe2+还原反应:2H++2e-= H2↑则下列正确的是( )
①Fe+2Fe3+=3Fe2+可分成 氧化反应:Fe-2e-= Fe2+ 还原反应:2 Fe3+ + 2e-=2 Fe2+
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O可分为
氧化反应:2Cl--2e-=Cl2↑ 还原反应:MnO2+2e-+4H+=Mn2++2H2O
③Cl2+H2S=S↓+2H++2Cl- 氧化反应:H2S- 2e-=S↓+ 2H+ 还原反应:Cl2+ 2e-=2Cl-
A.③ B.②③ C.①② D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省高一第二学期期末化学试卷(解析版) 题型:选择题
下列各项中表达正确的是 ( )
A.F—的结构示意图: 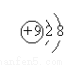 B.CH4分子的比例模型:
B.CH4分子的比例模型: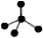
C.CCl4的电子式: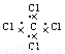 D.乙烯的结构简式:CH2CH2
D.乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市第一学期期末考试高二化学试卷(解析版) 题型:填空题
(9分)下表是不同温度下水的离子积常数:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | KW | 1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市第一学期期末考试高二化学试卷(解析版) 题型:选择题
下图为一原电池的结构示意图,下列说法中,错误的是
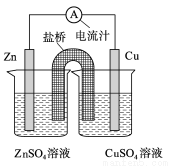
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市下学期期末考高一化学试卷(解析版) 题型:填空题
(6分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子
可与盐酸化合生成盐,该分子的电子式是 ;
周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填
氢化物化学式),原因是 ;
写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本
题涉及的含C元素的物质均易溶于水): 。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市下学期期末考高一化学试卷(解析版) 题型:选择题
反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s) B.v(A)= 0.030mol/(L ·s)
C.v(C)=0.040mol/(L· s) D.v(D)=0.060mol/(L· s)
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省岐山县第二学期高一期末化学试卷(解析版) 题型:选择题
如下图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述中正确的是
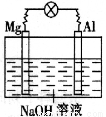
A.镁比铝活泼,镁失去电子被氧化成Mg2+。
B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com