
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是
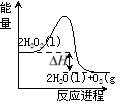
A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流程如下,思考解答下列问题:

(1)实验操作③的名称是______。
(2)根据元素周期表中元素性质的递变规律,实验操作④反应的离子方程式是______。
(3)实验操作⑤中不选用酒精的理由:_______。
(4)为使海带灰中碘离子转化为碘的有机溶液,实验室里有烧杯玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器物品,尚缺少的玻璃仪器是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图为汽车尾气处理系统中“三元催化”的工作原理,NO和CO在催化剂作用下生成无污染性物质的方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
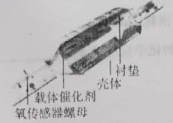
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 同种催化剂的比表面积/m2·g-1 | c(CO)不变时所用的时间/min |
① | 参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
② | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
③ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(1)实验编号②的实验目的为_______。
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是________。
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
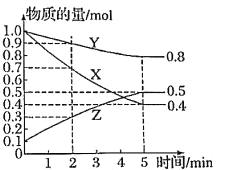
(1)该反应的化学方程式是______。
(2)该反应达到平衡状态的标志是
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.向混合液中加入过量的锌粉,过滤所得沉淀中含有两种金属
B.若向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl-
C.若向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D.若向废液中滴加KSCN 溶液,无现象,再加入氯水后溶液呈血红色,说明废液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
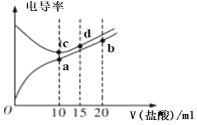
A.滴定氨水的过程应该选择甲基橙作为指示剂
B.a 点溶液中:c(H+)+c(NH4+)-c(OH-)=0.05 mol·L-1
C.b 点溶液中:c(H+)=c(OH-)+c(NH4+)+2c(NH3H2O)
D.a、b、c 三点的溶液中,水的电离程度c> b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技创新的产品设备在工作时,能量转化过程与氧化还原反应有关的是( )
|
|
|
|
①长征三号运载火箭用偏二甲肼为燃料 | ②嫦娥四号月球探测器上的太阳能电池板 | ③和谐号动车以350 km/h飞驰 | ④世界首部可折叠柔屏手机通话 |
A.①②B.③④C.②③D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com