
【题目】新冠疫情期间使用大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
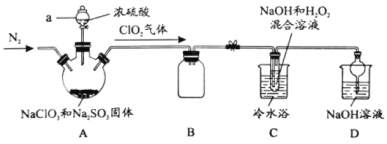
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称_________。
(2)装置A中发生反应的化学方程式:________。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是_______。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;③_________; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式________。
(6)实验结束后,继续通入一段时间N2的目的是________。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2![]() =
=![]() +2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
+2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
【答案】分液漏斗 2NaClO3 + H2SO4 + Na2SO3=== 2Na2SO4 + 2ClO2 ↑ + H2O NaClO3 、 NaCl 用38℃~60℃热水洗涤 2ClO2+H2O2+2OH-===2![]() +2H2O+O2 将装置内残留的ClO2全部排出,提高产率 溶液由蓝色褪为无色,且30秒内不复原 90.3%
+2H2O+O2 将装置内残留的ClO2全部排出,提高产率 溶液由蓝色褪为无色,且30秒内不复原 90.3%
【解析】
由题中信息可知,A装置中制备二氧化氯气体,该气体经安全瓶B进入C装置,在碱性条件下二氧化氯被双氧水还原为亚氯酸钠,D装置为尾气处理装置。有关纯度的计算可以根据反应的关系式进行。
(1)由仪器a的构造可知其为分液漏斗。
(2)装置A中NaClO3、H2SO4、Na2SO3发生反应生成ClO2,该反应的化学方程式为2NaClO3+ H2SO4+ Na2SO3=== 2Na2SO4 + 2ClO2↑ + H2O。
(3)由题中信息可知,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是NaClO3 、 NaCl。
(4) 由题中信息可知,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,因此,若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下:①减压,55℃蒸发结晶; ②趁热过滤;③用38℃~60℃热水洗涤(除去其中的可溶性杂质); ④低于60℃干燥,得到成品。
(5)装置C 中,在碱性条件下二氧化氯被双氧水还原为亚氯酸钠,该反应的离子方程式为2ClO2+H2O2+2OH-===2![]() +2H2O+O2。
+2H2O+O2。
(6)实验结束后,装置内还有残留的ClO2,若不排出,则产品的产率会降低,因此继续通入一段时间N2的目的是:将装置内残留的ClO2全部排出,提高产率。
(7)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,碘离子被亚氯酸钠氧化为碘,再滴加几滴淀粉溶液作指示剂,溶液变蓝,然后用0.0600 mol/L Na2S2O3标准溶液滴定,反应完成后溶液的蓝色褪去,因此,当出现溶液由蓝色褪为无色,且30秒内不复原,达到滴定终点。若共消耗该标准溶液25.00 mL,由ClO2-+4I-+4H+=Cl-+2I2+2H2O、I2+2![]() =
=![]() +2I-,可以得到关系式NaClO2·3H2O~2I2~4
+2I-,可以得到关系式NaClO2·3H2O~2I2~4![]() ,则25.0 mL 样品溶液中,n(NaClO2·3H2O)=
,则25.0 mL 样品溶液中,n(NaClO2·3H2O)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() 25.0010-3L0.0600 mol/L=
25.0010-3L0.0600 mol/L=![]() 0.0000600mol,该试样中NaClO2·3H2O的百分含量为
0.0000600mol,该试样中NaClO2·3H2O的百分含量为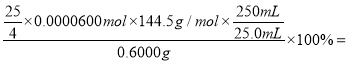 90.3%。
90.3%。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是( )
A.缩小反应体系的体积,化学反应速率加快
B.c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C.升高温度正反应速率加快,逆反应速率减慢
D.0~15s内用I2表示的平均反应速率为v(I2)=0.002mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的化工产品,广泛应用于化学合成、医疗消毒等领域。
(1)过氧化氢的电子式为_____________。
(2)工业上电解硫酸氢盐溶液得到过二硫酸盐(![]() ),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
(3)298K时,实验测得反应![]() 在不同浓度时的化学反应速率如表:
在不同浓度时的化学反应速率如表:
实验编号 | 1 | 2 | 3 | 4 | |
c(HI) /mol﹒L-1 | 0.100 | 0.200 | 0.300 | 00.100 | 0.100 |
c(H2O2)/mol﹒L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v//mol﹒L-1﹒s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
已知速率方程为![]() ,其中k为速率常数。
,其中k为速率常数。
根据表中数据判断:a=_______,b=________。
(4)“大象的牙膏”实验是将浓缩的过氧化氢与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。反应中H2O2的分解机理为:
![]() 慢
慢
![]() 快
快
此反应过程中无催化剂和有催化剂的能量变化关系图像如图所示:
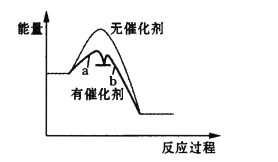
则表示慢反应的曲线是__________(填“a”或“b”)。
1mol H2O2分解放出热量98 kJ,则H2O2分解的热化学方程式为_________________。
(5)某科研团队研究![]() 体系(其中
体系(其中![]() )氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
)氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
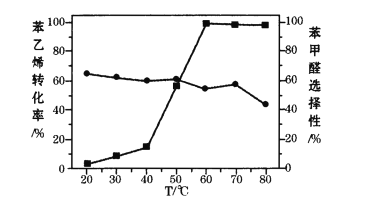
注:■苯乙烯转化率 ●苯甲醛选择性
①80℃时苯乙烯的转化率有所降低,其原因可能是_______。
②结合苯乙烯的转化率,要获得较高的苯甲醛产率,应该选择的温度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
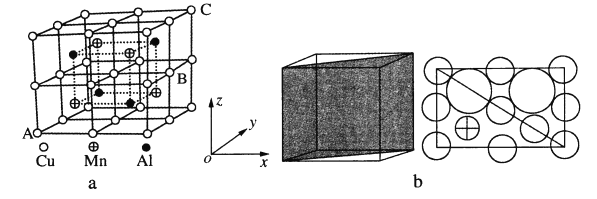
【题目】Cu—Mn—Al合金为磁性形状记忆合金材料之一,可用来制作各种新型的换能器、驱动器、敏感元件和微电子机械操纵系统。
(1)下列状态的铝中,最外层电离出一个电子所需能量最小的是______(填标号)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)AlCl3是某些有机反应的催化剂,如苯与乙酰氯反应的部分历程为:

①乙酰氯分子中碳原子的杂化类型为____。
②乙酰氯分子中∠CCCl___120°(填“>”、“=”或“<”),判断理由是_______。
③![]() 的空间构型为________。
的空间构型为________。
(3)温度不高时气态氯化铝为二聚分子(其结构如图所示)。

写出Al2Cl6的结构式并标出配位键______。
(4)Cu—Mn—合金的晶胞如图a所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0,0),C为(1,1,1),则B原子的坐标参数为_____。
②由晶胞可知该合金的化学式为_____。
③已知r(Cu)≈r(Mn)=127pm,r(Al)=143pm,则Cu原子之间的最短核间距离为____pm。
④该晶胞的密度为_____g·cm-3。(列出计算式即可,阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1molL-1NaOH溶液滴定20mL0.1molL-1CH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图。下列说法不正确的是( )
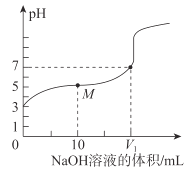
A.0.1molL-1CH3COOH溶液中,由水电离出的c(H+)<10-7molL-1
B.V1<20
C.M点溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.二者等体积混合时,c(Na+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2质量计),某研究小组同学设计了如下实验方案:
I.称取样品Wg后加入足量稀硫酸;
II.将I中产生的SO2用足最H2O2溶液吸收;
III.将II所得溶液用0.lmolL-1氢氧化钠溶液滴定,消耗体积为VmL;
IV.数据处理。
下列是小组同学对实验的设计、分析及数据处理,其中正确的是( )
A.步骤I中可用稀硝酸代替稀硫酸
B.1kg样品中含SO2的质量为![]() g
g
C.若用”溴水”替换II中的氧化剂“H2O2溶液”,对测定结果无影响
D.步骤I中生成的SO2残留在装置中未被H2O2溶液吸收,可能导致测得亚硫酸盐含量偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列三种有机物:
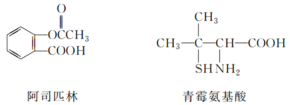
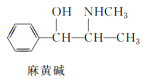
下列叙述不正确的是( )
A.三种有机物都能发生取代反应
B.1mol阿司匹林最多能与3molNaOH反应
C.麻黄碱属于芳香烃,苯环上的一氯代物有3种
D.青霉氨基酸既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
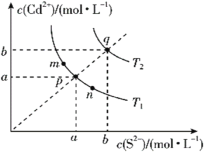
A.T1时CdS在c(S2-)=0.01mol/L的Na2S溶液中,c(Cd2+)=100a2mol/L
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com