
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
考点: 吸热反应和放热反应.
专题: 化学反应中的能量变化.
分析: A.生成物的总能量不一定低于反应物的总能量,有的反应生成物的总能量高于反应物的总能量;
B.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
C.根据盖斯定律含义结合应用进行解答;
D.化学反应的焓变与反应物和生成物的键能有关;
解答: 解:A.当反应物的能量低于生成物总能量时,反应是吸热反应.如CaCO3 CaO+CO2↑;当反应物的能量高于生成物总能量时,反应是放热反应,如CaO+H2O=Ca(OH)2,故A错误;
CaO+CO2↑;当反应物的能量高于生成物总能量时,反应是放热反应,如CaO+H2O=Ca(OH)2,故A错误;
B.多数分解反应是需要吸热的,但有些分解反应是放热反应,如:2H2O2(l)=2H2O(l)+O2(g)△H3=﹣196.4kJ•mol﹣1,故B错误;
C.盖斯定律是指一个反应若可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同与反应的途径无关,应用盖斯定律,可计算某些难以直接测量的反应的焓变,如利用盖斯定律计算C不完全燃烧生成CO的焓变,故C正确;
D.反应物的总能量与产物的总能量决定反应热效应,化学反应的焓变与反应物和生成物的键能有关,所以同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下△H相同,故D错误;
故选C.
点评: 本题考查热效应的含义的理解,理解并掌握盖斯定律的应用是解答本题的关键,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
向10mL 0.1mol•L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是()
A. x=10时,溶液中有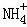 、Al3+、
、Al3+、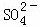 ,且c(
,且c(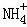 )=c(Al3+)
)=c(Al3+)
B. x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C. x=30时,溶液中有Ba2+、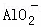 、OH﹣,且c(OH﹣)>c(
、OH﹣,且c(OH﹣)>c(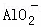 )
)
D. 滴加过程中,生成沉淀的最大物质的量为0.003mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
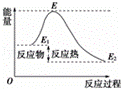
A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值
D. 活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E﹣E1
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是()
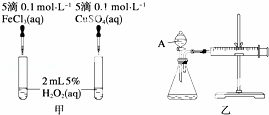
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式分析,C(s)的燃烧热△H等于()
C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol﹣1
2CO(g)+O2(g)=CO2(g);△H2=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l);△H3=﹣571.6kJ•mol﹣1.
A. △H1+△H2﹣△H3 B. 2△H1+△H2+△H3
C. △H1+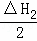 +△H3 D. △H1+
+△H3 D. △H1+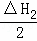 +
+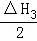
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com