
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知2A2(g)+B2(g) 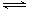 2C
2C 3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系
之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变 
 c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
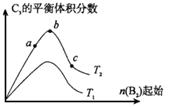
(5)改变某一条件,得到如图的变化规律 (图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d. b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起 始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b .增大压强 c.及时分离生成的C3 d.升高温度
.增大压强 c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C6H12O2的有机物A,有香味,不能使紫色石蕊试液变红。A在酸性条件下水解生成有机物B和C。B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应生成烯烃,能催化氧化生成醛或酮。则A可能的结构有( )。
A.1种 B.3种 C.5种 D.多于5种
查看答案和解析>>
科目:高中化学 来源: 题型:
β 月桂烯的 结构如图所示,一分子 该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有 ( )
该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有 ( )

A.2种 B.3种 C.4种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,错误的是 ( )
A.苯与浓硝酸、浓硫酸共热并保持55~60 ℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是 ( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.乙烯和甲苯分子中所有原子都在同一个平面上
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. 和CH3—CH===CH2互为同分异构体
和CH3—CH===CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于仪器使用的说法正确的是
A.在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器
B.熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚
C.蒸发结晶实验中,蒸发皿应放在石棉网上加热
D.在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶
液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是___________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液 分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com