
【题目】下列物质按酸、碱、盐分类依次排列正确的是( )
A.硫酸、纯碱、食盐
B.盐酸、生石灰、醋酸钠
C.醋酸、烧碱、硫酸铜
D.磷酸、石灰石、苛性钠
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素。W的气态氢化物水溶液能刻蚀玻璃,X为同周期中原子半径最大的元素,Y的单质在常温下遇浓硫酸钝化,Z与W同主族。回答下列问题:
(l)W在元素周期表中的位置是____。
(2)Z的单质与水反应生成含氧酸分子的电子式为____。
(3)X的最高价氧化物对应水化物溶液与Y的单质反应,其反应的离子方程式为____。
(4)不能通过加热Y与Z形成的化合物水溶液而得到其固体的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知七种短周期元素a~g的有关信息如下表所示:
元素编号 | a | b | c | d | e | f | g |
原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合价或最低化合价 | +1 | ﹣2 | +3 | ﹣2 | +3 | +1 | +1 |
下列推断不正确的是( )
A. 氢化物稳定性的强弱:b>dB. 金属性的强弱:f<g
C. 元素e的氧化物只能与酸反应D. 元素a与元素d形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
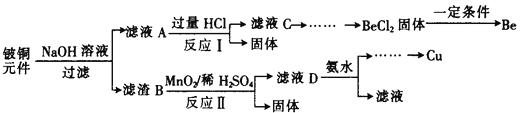
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10![]() Ksp[Fe(OH)3]=4.0×10
Ksp[Fe(OH)3]=4.0×10![]() Ksp[Mn(OH)2]=2.1×10
Ksp[Mn(OH)2]=2.1×10![]()
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式),
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________。
(2)溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序___________。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是________________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。

下列说法正确的是
A. 由实验数据可知实验控制的温度T1<T2
B. 020 min内,CH4的降解速率:②>①
C. 40 min时,表格中T1对应的数据为0.18
D. 组别②中,010 min内,NO2的降解速率为0.0300 mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石是一种古老的玉料,常与其它含铜矿物共生(蓝铜矿、辉铜矿、赤铜矿、自然铜等),主要成分是Cu(OH)2CuCO3,含少量FeCO3及硅的氧化物。实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

已知:Fe3+在水溶液中存在Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
Fe(OH)3开始沉淀的pH=2.7,沉淀完全的pH=3.7。
(1)为了提高原料的浸出速率,可采取的措施有________。
(2)步骤I所得沉淀主要成分的用途为________。
(3)步骤Ⅱ中试剂①是____________(填代号)
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
加入试剂①反应的离子方程式为:________。
(4)请设计实验检验溶液3中是否存在Fe3+:___________。
(5)测定硫酸铜晶体(CuSO4xH2O)中结晶水的x值:称取2.4500g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6000g。则计算得x=______(计算结果精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是

A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/ kJ·mol-1 | |
硫酸 | 碱溶液 | |||
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(1)实验①中碱液过量的目的是____________________。
(2)甲同学预计ΔH1≠ΔH2,其依据是______________________。
(3)若实验测得①中终了温度为31.8 ℃,则该反应的中和热ΔH1=________(已知硫酸、NaOH溶液密度近似为1.0 g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH________(填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒沙特列原理解释的是
A. 浓度均为0.1 mol·L-1的新制氯水,加入少量NaHSO3晶体,片刻后,溶液中HClO分子的浓度减小
B. 室温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL后,测得其pH<5
C. 在硫化氢水溶液中加入碱有利于S2—的生成
D. 增大压强更利于合成氨反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com