
科目:高中化学 来源: 题型:填空题
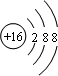 ;
;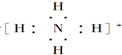 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 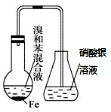 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 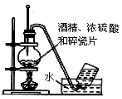 实验室制备并收集乙烯 | |
| C. | 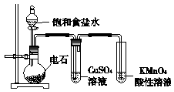 制备乙炔并检验其性质 | |
| D. | 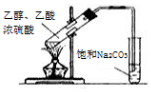 乙醇与乙酸反应制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 | |
| D. | 氢氧化铝具有弱性,可用于制胃酸中和剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com