
| A、若加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 |
| B、若加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-或Ag+的存在 |
| C、若通入Cl2后,溶液变为黄色,再加入淀粉碘化钾溶液后溶液变蓝,则原溶液可能有I-存在 |
| D、若加入盐酸,生成无色无味气体且能使澄清石灰水变浑浊,可确定一定有CO32- |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、温度相同,体积相同的O2和N2 |
| B、温度相等,压强相等的N2和 C2H4 |
| C、压强相同,质量相同的O3和O2 |
| D、体积相同,密度相等的CO 和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、①②⑤⑥ |
| C、②③④⑥ | D、③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究小组为了探究能与二氧化锰反应的盐酸的最低浓度,设计了如图所示的实验装置,向圆底烧瓶中加入20mL 12mol?L-1浓盐酸和足量二氧化锰粉末,加热,已知装置B和C中的试剂都是足量(不考虑反应过程中烧瓶内溶液体积的变化)
某化学研究小组为了探究能与二氧化锰反应的盐酸的最低浓度,设计了如图所示的实验装置,向圆底烧瓶中加入20mL 12mol?L-1浓盐酸和足量二氧化锰粉末,加热,已知装置B和C中的试剂都是足量(不考虑反应过程中烧瓶内溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、向沸水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色可制Fe(OH)3胶体 |
| D、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,201.4g |
| C、1000mL,201.4g |
| D、500mL,212g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 催化剂 |
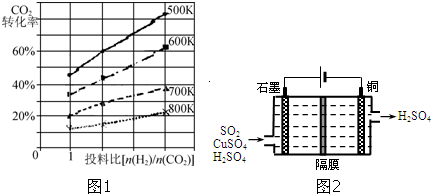
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com