
(12分)某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: ▲ 。
Ⅱ:丙学生用0.100mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(1) 根据以上数据计算出盐酸的物质的量浓度为 ▲ mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。 ▲ 。
科目:高中化学 来源: 题型:阅读理解
 Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:
Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:湖北省孝感高级中学2011-2012学年高二上学期期中考试化学试题 题型:058
已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
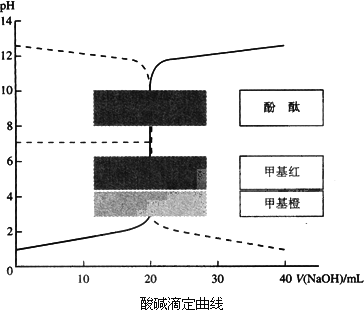
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中________(填“实线”或“虚线”).
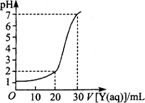
(2)下图为对10 mL一定物质的量浓度的硫酸氢钠溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是________和________.
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100 mL)的测定.他们进行以下滴定操作:
A.取某品牌白醋25.00 mL置于________(填仪器名称)中,用蒸馏水稀释10倍.
B.用________(填仪器名称)量取稀释后的白醋溶液20.00 mL,量于250 mL锥形瓶中,滴入________(填指示剂名称)1~2滴.
C.用0.05mol·L-1 NaOH标准溶液滴定,至终点.记下初始与终点读数.(注意:滴定重复进行3次.)
根据以上操作,请你继续回答下列问题.
①(C)中,滴定时,两眼注视________;终点的判断依据是________.
②误差分析:下列操作中能使测定结果偏高的是
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶.
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)__________________________________;
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】(1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是______________________;证明分解产物中有CO的现象是______________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【研究课题】 探究草酸晶体受热分解的产物
【查阅资料】 该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点/℃ | 密度/g·cm-3 |
草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175 ℃以上开始分解。
【提出猜想】(1)_____________________________________________________。
(2)分解产物中的气体可能是CO、CO2或它们的混合物。
【设计方案】 (1)请设计完成“猜想(1)”的实验方案〔用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂〕。

(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是___________________________;证明分解产物中有CO的现象是_________________________________________________________________。
②若未连接装置G,要达到同样的目的,可采取的措施是______________________________
_____________________________________________________________________。
【交流讨论】 小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
_____________________________________________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) |
| 草酸 | H2C2O4 | ― | 易溶于水 | 189.5 |
| 草酸晶体 | H2C2O4?2H2O | 无色晶体 | ― | 101.5 |
(备注:草酸晶体失去结晶水后,175℃以上开始分解)
【提出猜想】(1) ;
(2)分解产物中气体可能是CO、CO2或它们的混合物。
【设计方案】(1)请设计验证“猜想(1)”的实验方案。其中所使用的试剂是 ;
(2)化学学习小组的同学继续利用下图所示装置进行“猜想(2)”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。

①证明分解产物中有CO2的现象是 ;
证明分解产物中有CO的现象是 ;
②装置B的作用是 ;
③若未连接装置G,要达到同样的目的,可采取的措施是 。
【交流讨论】小李同学继续查阅相关资料发现:草酸为二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李进―步研究后,对实验中CO2的检验方案提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。 。
【实验结论】写出草酸晶体受热分解的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com