
有机物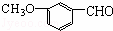 ,有多种同分异构体,其中属于酯且含有苯环结构的共有( )
,有多种同分异构体,其中属于酯且含有苯环结构的共有( )
A. 3种 B. 4种 C. 5种 D. 6种
科目:高中化学 来源: 题型:
X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
|
| A. | X原子的电子层数比Y原子的电子层数多 |
|
| B. | X的氢化物的沸点比Y的氢化物沸点低 |
|
| C. | X的气态氢化物比Y的气态氢化物稳定 |
|
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法不正确的是()
A. 升高温度可使该反应的逆反应速率降低
B. 使用高效催化剂可有效提高正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各离子浓度的大小比较,正确的是()
A. 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④
B. 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl﹣)
C. 0.2 mol•L﹣1Na2CO3溶液中:c (OH﹣)=c (HCO3﹣)+c (H+)+c (H2CO3)
D. 0.01 mol•L﹣1的NH4Cl溶液与0.05mol•L﹣1的NaOH溶液等体积混合:c (Cl﹣)>c (NH4+)>c (Na+)>c (OH﹣)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
由CH3CH=CH2合成CH2(OOCCH3)CH(OOCCH3)CH2(OOCCH3)时,需要经过的反应( )
A. 加成→取代→取代→取代 B. 取代→加成→取代→取代
C. 取代→取代→加成→取代 D. 取代→取代→取代→加成
查看答案和解析>>
科目:高中化学 来源: 题型:
有Xn+、Ym+、Zn﹣,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X→Y→Z的顺序,下列说法中正确的是( )
A. 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B. 它们的原子半径依次增大
C. 它们的单质在常温.常压下的密度依次减小
D. 它们的最高价氧化物的水化物都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0.关于该反应叙述不正确的是()
A. 该反应属于分解反应、氧化还原反应、放热反应
B. 该反应瞬间能产生大量高温气体,推动飞船飞行
C. 从能量变化上看,该反应是化学能转变为热能和动能
D. 反应中NH4ClO4只起到氧化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录。
| 步 骤 | 现 象 |
| I. 取5 mL 0.1 mol/L AgNO3与一定体积0.1 mol/L NaCl溶液,混合,振荡。 | 立即产生白色沉淀 |
| II. 向所得悬浊液中加入2.5 mL 0.1 mol/L Na2S溶液。 | 沉淀迅速变为黑色 |
| III. 将上述黑色浊液,放置在空气中,不断搅拌。 | 较长时间后,沉淀变为乳白色 |
| IV. 滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液。 | 产生红棕色气体,沉淀部分溶解 |
| V. 过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液。 | 产生白色沉淀 |
(1) 为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 。
(2) 已知:25℃时Ksp(AgCl)=1.8×10-10 ,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K= 。
(3)步骤V中产生的白色沉淀的化学式为 ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 。
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
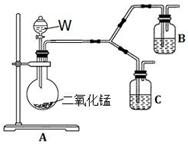
①装置A中玻璃仪器有圆底烧瓶、导管和 ,试剂W为 。
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 。
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:
□Ag2S + □NaCl + □ + □  □AgCl + □ S + □
□AgCl + □ S + □
B中NaCl的作用是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com