
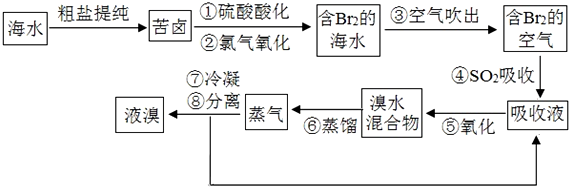
分析 空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,
(1)氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸,发现其颜色变化失常的原因是溶液中存在次氯酸具有漂白性;
(2)Br2和SO2发生氧化还原反应生成HBr和H2SO4,以此书写离子方程式,反应中二氧化硫中硫元素化合价+4价升高到+6价,体现二氧化硫的还原性;
(3)可用分液的方法分离液溴与溴水的混合物,液溴密度大于水;
(4)氯化后的海水虽然含有溴单质,但浓度低,产量低.
解答 解:空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是,溶液中的HClO将pH试纸漂白,
故答案为:溶液中的HClO将pH试纸漂白;
(2)Br2和SO2发生氧化还原反应生成HBr和H2SO4,反应的方程化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,反应中二氧化硫中硫元素化合价+4价升高到+6价,体现二氧化硫的还原性,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr; 还原;
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离,液溴密度大于水,分离时从分液漏斗的上口倒出的是溴水,
故答案为:溴水;
(4)氯化后的海水虽然含有溴单质,但浓度低,产量低,应经过“空气吹出、SO2吸收、氯化”的过程进行富集,如果直接蒸馏原料,产品成本高,与直接蒸馏含Br2的海水相比优点是消耗更少成本,效率更高,
故答案为:浓缩(或富集);效率更高.
点评 本题考查溴的制取,主要是海水提取溴的过程分析,题目难度中等,注意实验的基本操作,把握实验基本方法和注意事项.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | N2(CO):通过灼热的CuO粉末 | B. | SO2 (HCl):通入饱和碳酸氢钠溶液中 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质及变化 | 描述 | 相关知识 | |
| A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
| B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
| C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
| D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
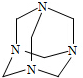
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com