
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、X2气过量 |
| B、X2气Y2气各50mL |
| C、产物是双原子分子 |
| D、无法作出上述判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用分液法分离酒精和水 |
| C、用四氯化碳萃取碘水中的碘 |
| D、用蒸馏的方法将自来水制成蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④ |
| C、②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀盐酸,产生无色无味气体,将气体通入澄清石灰水中 | 生成白色沉淀 | 原溶液中有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol?L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:漂白粉溶液Y:二氧化硫 |
| B、X:硝酸银溶液Y:氨气 |
| C、X:氢氧化钡溶液Y:二氧化碳 |
| D、X:偏铝酸钠溶液Y:二氧化氮 |
查看答案和解析>>
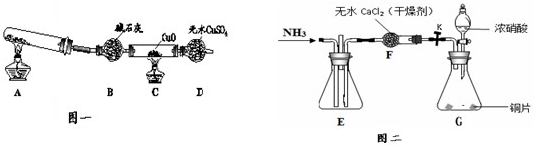
科目:高中化学 来源: 题型:
| △ |
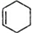 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.下图是关于物质A的一种制备方法及由A引发的一系列化学反应.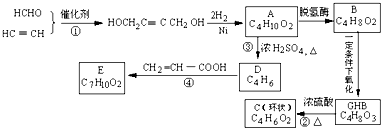
 结构),它的结构简式为
结构),它的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.
如图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com