
| A.反应混合物的浓度 | B.反应物的转化率 |
| C.正、逆反应速率 | D.体系的压强 |
科目:高中化学 来源:不详 题型:单选题
 pC(气)+qD(气)+ Q有下列判断,其中正确的是
pC(气)+qD(气)+ Q有下列判断,其中正确的是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( ) | A.70% | B.60% | C.50% | D.40% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO | B.石脑油(C5H12、C6H14) | C.CH4 | D.焦碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铷的金属活动性不如镁强,镁可置换出铷 |
| B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C.铷的单质状态较化合态更稳定 |
| D.MgCl2的热稳定性不如RbCl强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是| A.单位时间生成n mol的A2同时生成n mol的AB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2n mol的AB同时生成n mol的B2 |
| D.单位时间生成n mol的A2同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a% > b% | B.a%< b% | C.a%=" b%" | D.无法判定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |
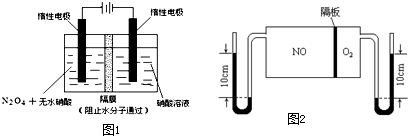
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com