
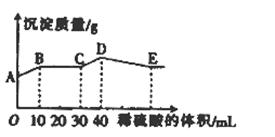
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O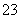 与Cl2反应的产物之一为SO
与Cl2反应的产物之一为SO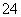 。下列说法中,错误的是( )
。下列说法中,错误的是( )
A.该反应中的氧化剂是S2O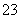
B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂
C.上述反应中,每生成1 mol SO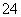 ,
, 可脱去2 mol Cl2
可脱去2 mol Cl2
D.根据该反应可判断还原性:S2O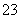 >Cl-
>Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
在系统命名法中下列碳原子主链名称是丁烷的是
( )
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )

A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,
则反应①的化学方程式4NH3+5O2 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的
量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
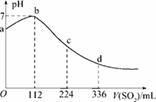 A.ab段反应是:SO2+2H2S===3S↓+2H2O
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、
S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
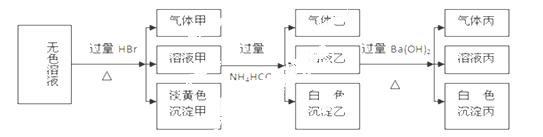
试回答下列问题:
(1)生成沉淀甲的离子方程式为: 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有: 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为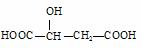 ,下列说法正确的是( )
,下列说法正确的是( )
A.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
B.1mol苹果酸可与3mol NaOH发生中和反应
C.1mol苹果酸与足量金属Na反应生成生成1mol H2
D.苹果酸在一定条件下能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2A2(g)+B2(g) 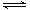 2C
2C 3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系
之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变 
 c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律 (图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d. b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起 始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b .增大压强 c.及时分离生成的C3 d.升高温度
.增大压强 c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学弄清楚喷泉实验的原理后,有了一个创新的想法,如果改换一下烧瓶内的气体,以及胶头滴管和烧杯内的液体,也应该可以做喷泉实验。他用课本上所用的装置实际做了一下,果真得到了美丽的喷泉。下列组合中不可能是该同学设计的组合的是( )
A.氯化氢和水 B.氧气和水 C.二氧化碳和NaOH溶液 D.氯气和NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com