
| A. | 标准状况下,22.4L NO与11.2L O2混合充分反应,产物的分子数为NA | |
| B. | 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA | |
| C. | l mol Cu与足量的硫充分反应,电子转移数为2NA | |
| D. | 100mL l mol•L-1KClO溶液中,阴离子的数目小于0.1NA |
分析 A.NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4;
B.乙烯与丙烯具有相同最简式CH2,1个CH2含有2个C-H键;
C.铜与硫反应生成硫化亚铜;
D.根据电荷守恒来分析.
解答 解:A.标准状况下,22.4L NO与11.2L O2混合完全反应生成二氧化氮物质的量为1mol,NO和氧气反应后的产物NO2中存在平衡:2NO2?N2O4,故反应后的产物分子个数小于NA个,故A错误;
B.14g乙烯和丙烯混合气体含有CH2物质的量为$\frac{14g}{14g/mol}$=1mol,含有C-H共价键的数目为2NA,故B正确;
C.铜与硫反应生成硫化亚铜,l mol Cu与足量的硫充分反应生成0.5mol硫化亚铜,电子转移数为NA,故C错误;
D.根据电荷守恒可知,溶液中存在:n(ClO-)+n(OH-)=n(K+)+n(H+),由于溶液中n(K+)=1mol/L×1L=1mol,故溶液中的阴离子的物质的量大于1mol,个数大于NA个,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意铜与硫粉反应生成产物为硫化亚铜,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
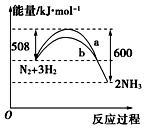 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个容积固定的密闭容器中充入1mol N2和 3mol H2使反应N2+3H2?2NH3达到平衡,测得反应放出热量为Q kJ查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发现了电子 | B. | 根据α提出了带核的原子结构模型 | ||
| C. | 引入的量子学说 | D. | 提出较为系统的化学原子学说 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
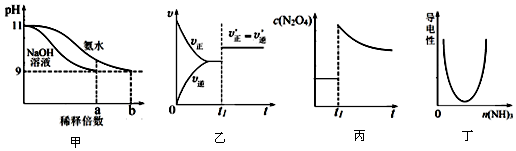
| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L 1mol/L过氧化氢溶液中含氧原子数为4NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 2mol MnO2与足量的浓盐酸加热充分反应,转移电子数为4NA | |
| D. | 密闭容器中2molNO2和1molO2充分反应,产物分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒的运动是有规律的,胶体中分散质微粒的运动是布朗运动 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com