
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。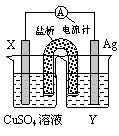
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的______ 极,发生的电极反应为__________;X电极上发生的电极反应为____________;
(3)外电路中的电子是从_______电极流向________电极。
(1)铜(或Cu);AgNO3溶液。 (2)正, Ag++e- = Ag; Cu-2e- = Cu2+。 (3)负(Cu);正(Ag)
解析试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此根据总的方程式可知,铜失去电子,做负极,所以X电极是铜。银电极是正极,则Y应该是硝酸银溶液。
(2)正极得到电子,电极反应式是Ag++e- = Ag; 负极电极反应式是Cu-2e- = Cu2+。
(3)外电路中的电子是从负极铜电极流向正极银电极。
考点:考查原电池的有关判断和应用
点评:该题是基础性试题的考查,也是高考中的常见题型。试题基础性强,侧重对学生基础知识的巩固与训练,难度不大。该题的关键是熟练记住原电池的工作原理,然后结合题意灵活运用即可。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
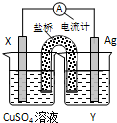 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应:
依据氧化还原反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| [CO] | [CO2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com