
| A. | Al3+ | B. | Al(OH)3 | C. | AlO2- | D. | Al3+ Al(OH)3 |
分析 明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,根据反应:SO42-+Ba2+=BaSO4↓,Al3++4OH-=AlO2-+2H2O判断.
解答 解:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-,
故选C.
点评 本题考查离子方程式的书写,题目难度不大,本题中注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
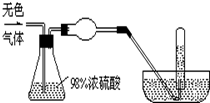 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 小苏打 | 干冰 |
| B | 蒸馏水 | 氨水 | 火碱 | 二氧化硫 |
| C | 硫酸 | 胆矾 | 纯碱 | 氨气 |
| D | 硝酸 | 食盐 | 氢氧化钠溶液 | 生石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com