
| A. | K=$\frac{[N{H}_{3}][HCl]}{[N{H}_{4}Cl]}$ | B. | K=$\frac{[N{H}_{4}Cl]}{[N{H}_{3}][HCl]}$ | C. | K=[NH3][HCl] | D. | K=$\frac{[N{H}_{3}]}{[N{H}_{4}Cl]}$ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用由CO2制备的聚碳酸酯降解塑料,可减少污染,实现碳的循环利用 | |
| B. | 铝合金因其密度小,硬度大,成为用量最大的合金 | |
| C. | 清洁燃料压缩天然气和液化石油气的主要成分是烃类 | |
| D. | 酱油加铁可以补充人体所需的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | Na2SO4(NH4Cl) | 加入升华 | |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | 只有② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
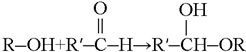 (产物统称半缩醛)
(产物统称半缩醛)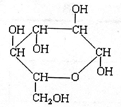
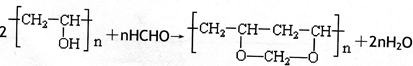
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com