
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.| 3 |
| 2 |
| 0.007 |
| 0.04×0.04 |
| 3 |
| 2 |


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CO+O2
| ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、C+H2O
| ||||
| D、CO2+Ca(OH)2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a mol |
| B、1.25a mol |
| C、2.5a mol |
| D、4a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 溶液 | 加入物质 |
| (1)氯化铝溶液 | 加入过量氨水 |
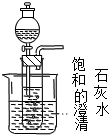
| (2)饱和石灰水 | 通过量CO2气体 |
| (3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
| (5)含少量HCl的AlCl3溶液 | 逐滴加入过量的氨水 |
| A、③①②④⑤ |
| B、③②①⑤④ |
| C、①③②⑤④ |
| D、①③②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②③ |
| C、②③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.5 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1mol甲烷含有的氢原子数为4NA |
| B、2g氦气所含有原子数为0.5NA |
| C、0.1mol/L的硫酸铝溶液中含SO42-数为0.3NA |
| D、18g水所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0△S<0 |
| B、△H<0△S>0 |
| C、△H>0△S<0 |
| D、△H>0△S>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com