
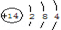 ;
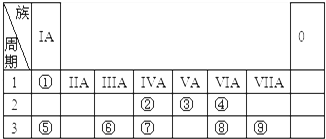
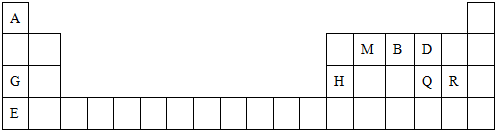
;分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为 Cl.
(1)⑦为Si,原子核外电子数为14,各层电子数为2、8、4;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;非金属性越强,最高价含氧酸的酸性越强;
(3)碳与浓硝酸反应生成二氧化碳、二氧化氮与水,碳与浓硫酸反应生成二氧化碳、二氧化硫与水;
(4)X、Y分别由元素O和Na、C和O形成,X与Y的反应是潜水艇和呼吸面具中氧气的来源,则X为Na2O2,Y为CO2.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为 Cl.
(1)⑦为Si,原子核外电子数为14,各层电子数为2、8、4,原子结构示意图为: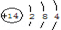 ,
,
故答案为: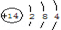 ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,原子半径:Na>Al>C,非金属性Cl>S>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4>H2SiO3,
故答案为:Na>Al>C;HClO4>H2SO4>H2SiO3;
(3)碳与浓硝酸反应生成二氧化碳、二氧化氮与水,碳与浓硫酸反应生成二氧化碳、二氧化硫与水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O或 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)X、Y分别由元素O和Na、C和O形成,X与Y的反应是潜水艇和呼吸面具中氧气的来源,则X为Na2O2,Y为CO2,二者反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,当反应中有3.01×1023个电子转移时,即转移电子为0.5mol,生成的氧气为$\frac{0.5mol}{2}$=0.25mol,则参加反应的二氧化碳质量为0.25mol×2×44g/mol=22g,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;22.
点评 本题考查元素周期表与元素周期律、元素化合物性质,熟练掌握元素周期表的结构,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 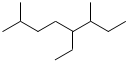 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |||||||||
| B. | 已知Ka是平衡常数,PKa=-lgKa
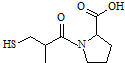 图所示有机物1mol最多能消耗含3molNaOH的溶液 图所示有机物1mol最多能消耗含3molNaOH的溶液 | |||||||||
| C. | 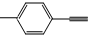 分子中所有原子共平面 分子中所有原子共平面 | |||||||||
| D. | 碳原子数小于或等于4的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 常温下,浓硝酸和浓硫酸不和铁、铝反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
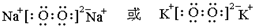 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 水电离出的c(OH-)=10-10mol•L-1:Al3+、NH4+、Ca2+、NO3- | |
| C. | c(H+)=10-14 mol•L-1 的溶液中:Na+、AlO2-、S2-、SO32- | |
| D. | pH试纸变红的溶液中:Fe3+、I-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
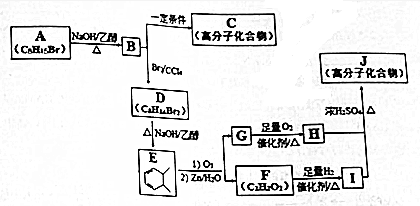
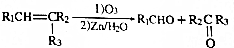
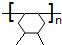 .
.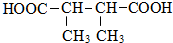 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$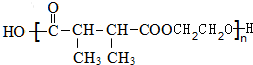 +(2n-1)H2O.
+(2n-1)H2O.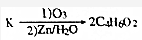 ,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式
,则K的同分异构体可能有7种(不考虑立体异构),写出其中一种的结构简式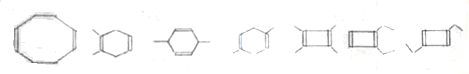 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com