
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
【知识点】元素周期表、元素周期律、常用化学用语、氧化还原反应 E2
【答案解析】(1)二周期 IVA族 14C (2)> < < =
(3)O=C=O 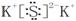 (4)O>N>C, D
(4)O>N>C, D
解析: (1)C元素位于元素周期表第二周期,第IVA族,14C可以测定文物年代;
(2)N3-、Al3为核外电子排布相同的离子,离子核电荷数越大,半径越小,则N3- 大于Al3+;非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;氧气的氧化性大于硫单质,则O2-小于S2-;35Cl与37Cl属于同一种元素,同种元素得电子能力相同。
(3)二氧化碳属于非电解质,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O;沸点最高是K2S,属于离子化合物,由钾离子与硫离子构成,其电子式为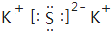 。
。
(4)C、N、O同周期,同周期随原子序数增大元素的非金属性增强,故非金属性O>N>C;
A.氧元素没有含氧酸,不能利用最高价比较氧元素与C、N元素的非金属性,故A错误; B.沸点属于物理性质,不能比较非金属性强弱,故B错误; C.单质与H2反应的难易程度,说明单质的氧化性的强弱,但单质的结构不同,不能说明元素的非金属性的强弱,故C错误; D.元素的化合价,说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,故D正确。
【思路点拨】本题考查了元素周期表、元素周期律、常用化学用语、氧化还原反应等,难度不大,(4)中证明非金属性强弱事实为易错点,学生容易忽略氧元素没有含氧酸及单质的结构的不同。


科目:高中化学 来源: 题型:
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
⑴ 已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和
-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的
甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
⑵ 在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得
CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|

 | 0 | 1 | 2 | 3 | 4 | ||||||
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 | ||||||
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
⑶ 已知温度、压强、投料比X对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
⑷ 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B. 酸性氧化物一定不能和酸反应
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。
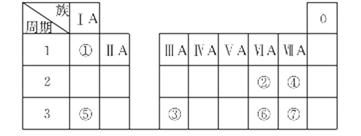
(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
在西安一座西汉古墓中出土了50多斤西汉时期的古酿,当开启酒坛封口时,散发出的香味把在场的品酒师都醉倒了,这些酒深藏地下历经两千年,不仅没有变质,反而变得香气更浓。这种香味是由哪种物质引起的( )
A.乙醇 B.乙酸
C.乙酸乙酯 D.乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
双酚A的结构简式如下图所示,下列有关此物质的说法正确的是( )

A.1 mol该物质与足量溴水反应消耗2 mol Br2
B.该物质能与碳酸氢钠溶液反应放出CO2
C.该物质的所有碳原子可能在同一平面
D.该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)与铁反应生成铜]。试写出该反应的化学方程式: ___________________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:_________________________________________________________。
这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式: _________________________________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是
1 534.8 ℃)_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com